
分析 正常雨水中溶解二氧化碳,为弱酸性,而溶解二氧化硫的雨水的酸性增强,pH<5.6,亚硫酸与氧气反应生成硫酸,酸性增强,pH变小,可控制二氧化硫的排放,减少酸雨的发生,以此来解答.
解答 解:未污染的雨水由于二氧化碳的缘故,一般呈现出弱酸性,当雨水的pH<5.6时,我们称之为“酸雨”.酸雨露置于空气中,经过一段时间后中,亚硫酸与氧气反应生成硫酸,酸性增强,pH值会变小;控制酸雨的措施有a.使用脱硫煤、c.用废碱液吸收烟气中的二氧化硫、d.开发新能源,均可减少二氧化硫的排放,只有b.加高工厂的烟囱不能减少二氧化硫的排放,
故答案为:二氧化碳;<;变小;acd.
点评 本题考查三废处理及环境保护,为高频考点,把握酸雨的形成、控制酸雨的措施为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | |||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | ||
| S-S | 255 | H-S | 339 | C-F | 427 | ||
| C-Cl | 330 | C-I | 218 | H-F | 568 | ||
| C-O | 351 | H-O | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质所含元素化合价升高的反应是氧化反应 | |
| B. | 物质所含元素化合价降低的反应是还原反应 | |
| C. | 氧化剂本身被还原,具有氧化性;还原剂本身被氧化,具有还原性 | |
| D. | 氧化反应和还原反应不一定同时存在于一个反应中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
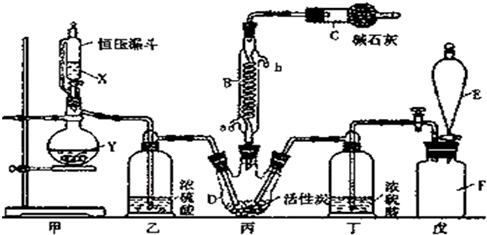
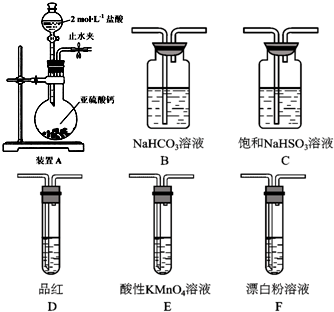
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
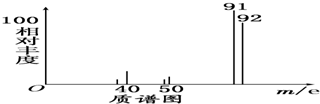
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
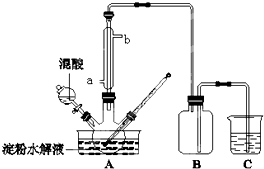 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a+0.5b-1.5c) kJ•mol-1 | B. | (a-0.5b+1.5c) kJ•mol-1 | ||
| C. | (2a+b-3c) kJ•mol-1 | D. | (2a+b+3c) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
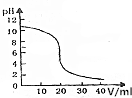 常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )
常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )| A. | V=10.00mL时,c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| B. | V=20.00mL时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗盐酸的体积大于20.00mL | |
| D. | pH=8时,c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日本的水俣病是由重金属镉污染引起的 | |
| B. | 垃圾处理要遵循无害化、减量化和资源化的原则 | |
| C. | 水体的富营养化是由于水体中植物营养物质过多蓄积而引起的污染 | |
| D. | 污水处理中混凝法、中和法、沉淀法、氧化还原法等都是化学方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com