
 ,晶体类型为分子晶体.
,晶体类型为分子晶体.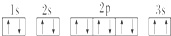 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;
D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;
E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;
F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,
G在第四周期周期表的第7列,G为Mn元素.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;
D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;
E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;
F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,
G在第四周期周期表的第7列,G为Mn元素.
(1)NH3为共价化合物,氨气分子中氮原子最外层达到8电子稳定结构,漏掉了氮原子的一对孤电子对,氨气的电子式为 ,是分子晶体,故答案为:
,是分子晶体,故答案为: ;分子晶体;
;分子晶体;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤形,
故答案为:3,纺锤;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为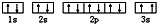 ,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,
,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,
故答案为:泡利原理;
(4)N和P的电负性,同主族从上往下电负性逐渐减小,所以电负性较大的是N,NCl3中心原子N原子成3个σ键,N原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥,
故答案为:N;sp3,三角锥;
(5)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2,
故答案为:d;3d54s2;
(6)F为K,检验K元素应利用焰色反应,故答案为:焰色反应.
点评 本题考查结构性质与位置关系、核外电子排布规律、电离能、杂化轨道理论、分子结构等,综合性较大,难度中等,推断元素是解题的关键,注意基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
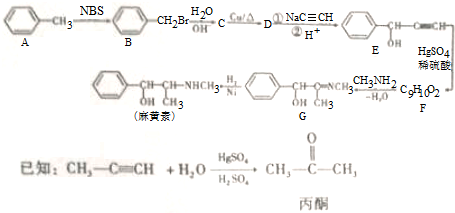

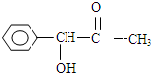 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)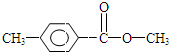 或
或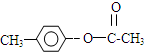 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
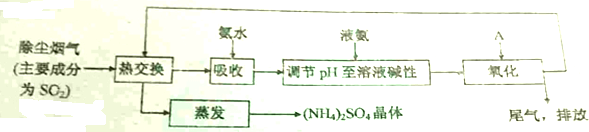
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com