
����Ŀ����ȸʯ����Ҫ�ɷ�ΪCu2��OH��2CO3 �� �����������������������������P����������ͼ1��ʵ�����Կ�ȸʯΪԭ���Ʊ��������������ͼ�� 
��ش��������⣺
��1����ҺA�еĽ��������� �� �����������Լ���ѡ��ʵ�鲽�����Լ���Ϊ������ţ�
a��KMnO4 b��HNO3c��H2O2 d��Cl2
��2������ͼ2�й����ݣ�����Ϊ��ҵ�ϼ����Լ�����������ʱӦ��ȡ�Ĵ�ʩ�ǣ���Һ�¶ȿ������棬pH������ �� ����ʱ��ΪСʱ���ң�
��3�����ⶨ��ҺA��Fe2+��Ũ�ȣ�����KMnO4����Һ�ζ�����Ӧ��MnO4����ԭΪMn2+ �� ȡA��Һ20.00mL����ȥ0.0240mol/L KMnO4��Һ16.00mLʱ��ǡ�ôﵽ�ζ��յ㣬��A��Һ��Fe2+Ũ��Ϊmol/L��
��4�������һ��ʵ�鷽��������ҺC��Fe3+�Ƿ���ȫ��ȥ��д���������衢����ͽ��ۣ� ��
��5������ҺC��õ������壬��Ҫ��������Ũ���������˵Ȳ��������ձ�©������˲������õ���һ�����������������ڴ˲����е���Ҫ������ ��
��6��Ϊ�ⶨ�����нᾧˮ��Ŀ����ȡ24.8g����ͭ����ʢװ�ڸ����
�����������ƣ���������������ٸı�ʱ��������ĩ������Ϊ16.0g���������õ�����CuSO4nH2O����n=����������ȷ��0.1����
���𰸡�
��1��Cu2+��Fe2+��Fe3+��c
��2��80��1.5��4
��3��0.096
��4��ȡ������Һ����������KSCN��Һ������Һ�����ɫ��˵��Fe3+����ȫ��ȥ������Һ���ɫ����˵��Fe3+δ��ȫ��ȥ
��5����ȴ�ᾧ������
��6��������4.9
���������⣺��1��������֪��ҺA��ҺA�еĽ��������У�Cu2+��Fe2+��Fe3+ �� ���Լ�1����Ŀ���ǽ���Һ�е�Fe2+ת��ΪFe3+ �� �Ҳ����������ʣ�����˫��ˮ��˫��ˮ��һ����ɫ�Լ�����Fe2+����ΪFe3+ �� �����������ʣ���ѡc��
���Դ��ǣ�Cu2+��Fe2+��Fe3+��c����2��������ͼ2�й����ݿ�֪��pHֵ���ʱ�¶�Խ��Fe2+ת����Խ�ߣ��¶����ʱpHֵԽСFe2+ת����Խ�ߣ����Թ�ҵ����������ʱӦ��ȡ�Ĵ�ʩ����Һ�¶ȿ�����80�棬pH������1.5������ʱ��Ϊ4Сʱ����Fe2+ת���ʴﵽ�ϴ�ֵ��4Сʱ�Ժ�仯����
���Դ��ǣ�80��1.5��4����3��Fe2+��Һ��KMnO4��Һ����������ԭ��Ӧ����Ӧ��MnO4������ԭΪMn2+ �� ��Ӧ�����ӷ���ʽΪMnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O���������ӷ��̿�֪MnO4����5Fe2+ �� ��ȥ KMnO4�����ʵ���Ϊ16.00mL��0.0240mol/L=3.84��10��4mol������A��Һ��Fe2+Ũ��Ϊ ![]() =0.096mol/L��
=0.096mol/L��
���Դ��ǣ�0.096����4�������ӵļ��鷽��Ϊȡ������Һ����������KSCN��Һ������Һ�����ɫ��˵��Fe3+����ȫ��ȥ������Һ���ɫ����˵��Fe3+δ��ȫ��ȥ��
���Դ��ǣ�ȡ������Һ����������KSCN��Һ������Һ�����ɫ��˵��Fe3+����ȫ��ȥ������Һ���ɫ����˵��Fe3+δ��ȫ��ȥ����5������ҺC��õ������壬��Ҫ��������Ũ������ȴ�ᾧ������ϴ�ӵõ���ˮ����ͭ�����ձ�©������˲������õ���һ��������Ϊ���������������ڴ˲����е���Ҫ������������
���Դ��ǣ���ȴ�ᾧ����������6����ȡ24.8g����ͭ����CuSO4nH2O��ʢװ�ڸ�����������������������ٸı�ʱ��������ĩ������Ϊ16.0g����ͭ�����ʵ���= ![]() =0.1mol��
=0.1mol��
CuSO4nH2O���ʵ���Ϊ0.1mol��M=248g/mol��
��������Ϊˮ��������ˮ���ʵ���= ![]() =0.49mol��
=0.49mol��
��n=4.9
���Դ��ǣ�������4.9��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC4H802�������У������������칹���� ��
A.2��
B.3��
C.4��
D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��g��B��g��+C��g�����ݻ�Ϊ1.0L���ܱ������н��У�A�ij�ʼŨ��Ϊ0.050mol/L���¶�T1��T2��A��Ũ����ʱ���ϵ����ͼ��ʾ���ش��������⣺ 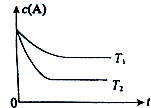
��1��������Ӧ���¶�T1T2 �� ƽ�ⳣ��K��T1��K��T2����������ڡ�����С�ڡ����ڡ���
��2�����¶�T2ʱ��5min��Ӧ�ﵽƽ�⣬A��ת����Ϊ70%���� ��ƽ��ʱ��ϵ�ܵ����ʵ���Ϊ ��
�ڷ�Ӧ��ƽ�ⳣ��K= ��
�۷�Ӧ��0��5min�����ƽ����Ӧ����v��A��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��H����ѧ��ѧ�еij������ʣ�A��C��G�ǽ�����E��F�������B����ˮ����ɫ��Һ����������ͼ��ʾ�Ĺ�ϵ����Ӧ�����ɵ�ˮ����ȥ�����Իش��������⣮ 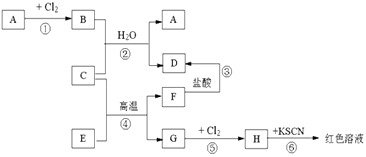
��1���ƶ���д���ʻ�ѧʽ��A�� �� D�� �� H��
��2����Ӧ�ܵĻ�ѧ����ʽΪ ��
��3���ý���C�Ʊ���һ�ֽ��������ǹ�ҵ�Ͻϳ��õķ������磺2C+4BaO ![]() 3Ba��+BaOC2O3
3Ba��+BaOC2O3
�ٳ�����C�Ľ����Ա�Ba�Ľ�������ѡ�ǿ������������
������������������ȡBa����Ҫԭ���� ��
a������ʱC�Ļ����Դ���Ba
b������������BaO�ֽ�
c������ʱBaOC2O3��C2O3�ȶ�
d������Ba�ķе�Ƚ���C�ĵ�
��4��Hˮ��Һ������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ
��5����51.2�˵�AͶ��200������������Һ��ǡ�÷�Ӧ��ȫ��������״���µ�NO2��NO��31.36L���������Ũ��molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98%��ŨH2SO4����=1.84g/cm3������500mL0.5mol/L��ϡH2SO4 �� �밴Ҫ����գ��ɹ�ѡ��������У��ٲ����� ����ƿ ���ձ� �ܽ�ͷ�ι� ����Ͳ ������ƿ ��������ƽ ��ҩ�ף�
��1�����������У�������ϡH2SO4ʱ�ò�������������ţ���
��2������ŨH2SO4�����ʵ���Ũ��Ϊ������ʱ����Ũ��������ΪmL�������������ݱ�����С�����һλ��
��3����Һ���Ʋ����������£�������Ͳ��ȡ�����Ũ���ᣬС�ĵ���250mL�ձ��У�
����250mL�ձ��㵹Լ100mL����ˮ��
��������ˮϴ���ձ���������2��3�Σ���ϴ��Һע������ƿ�У�
���ò�������������������Һ��ȴ�����£��ز�����ע��500mL������ƿ�У�
�ݽ�����ƿ�ǽ�����ҡ�ȣ�
��������ƿ��С�ļ�����ˮ��Һ��ӽ��̶�1��2cm�������ý�ͷ�ιܵμ�����ˮ��ʹ��Һ��Һ����͵�ǡ����̶������У���������˳����ȷΪ������ţ�
��4�����ڲ������������Т�ʱ��ʹҺ���Գ���������ƿ�Ŀ̶ȣ����ߣ�����ʱӦ��ȡ�Ĵ�ʩ��
A.�ټ�Ũ����
B.�����������ϵ���Һ
C.Ӱ�첻���ٴ���
D.��������
��5������ƿ��ר����������һ�����һ��Ũ�ȵ���Һ�������������й�����ƿ��������ȷ����
A.����ƿ�ϱ���ѹǿ���¶ȡ�����
B.����ƿ���ܳ�ʱ�������Լ�
C.Ϊʹʵ���ȷ������ƿϴ��������������Ƶ���Һ��ϴ
D.������ƿ������Һ������ƿ�����Ǹ����
��6�����в�����ʹ������Һ��Ũ��ƫ�ߵ��� ��
A.Ũ����ϡ�ͺ�δ�������¼����ж���
B.����ƿδ���T����������Һ
C.������ƿ��ת����Һʱ��������Һ�彦��
D.ҡ�Ⱥ���Һ����ڿ̶��ߣ�û��ȡ�κδ�ʩ
E.����ͲȡŨ����ʱ���ӿ̶���
F.����ʱ�����ӿ̶��ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2017������ʡ��������ͨ����ѧ��ѧҵˮƽģ�⿼��)������Ϊ���ϻ�ѧʵ�鰲ȫҪ�����
A����ʵ��ʣ��Ľ�����ֱ�Ӷ����ڷ�Һ����
B������ϡ����ʱ����ˮ��������Ũ�����в����Ͻ���
C����ȼCH4ǰ����������Ĵ���
D�������ж��������ܶȱȿ���������й©ʱ��Ѹ���뿪�ֳ����������ʹ�ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϊ�١����Ԫ�أ���Ԫ�����ڱ��е�λ�����£�
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | �� | ||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� |
�Իش��������⣺
��1����ԭ��ֻҪ�γ�һ�Թ��õ��ӶԾʹﵽ���ȶ��ṹ��Ԫ��������дԪ�ط��ţ���
��2���ٺܺ͢�Ԫ���γɵĻ�����Ļ�ѧʽΪ �� �õ���ʽ��ʾ���γɹ���Ϊ ��
��3�����Ԫ�ص�����������ˮ����Ļ�ѧʽ�� ��
��4���١��ݡ��ߺ�Ԫ���γɵ�һ�ֻ�����ĵ���ʽ�� �� �ڸû������мȺ��������ֺ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬���ش��������� 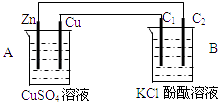
��1���ж�װ�õ����ƣ�A��ΪB��Ϊ
��2��ͭ��Ϊ�����缫��ӦʽΪ
��3��Bװ���У�C1��C2��Ϊʯī����ʯī��C1Ϊ�����缫��ӦʽΪ �� ʯī��C2����������ʵ������Ϊ
��4����C2������224mL����״̬������ʱ��п����������g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.��������Һ�м�������������Һ�����������ʵ����ﵽ���ֵ��Al3++2SO ![]() +2Ba2++4OH���T2BaSO4��+AlO
+2Ba2++4OH���T2BaSO4��+AlO ![]() +2H2O
+2H2O
B.�����ʯ��ˮ��ͨ������CO2��OH��+CO2�THCO ![]()
C.������Һ��ˮ���е�CaCO3��Ӧ��CaCO3+2CH3COOH�TCa2++2CH3COO��+H2O+CO2��
D.��������Һ�м���ͭ�ۣ�Ag++Cu�TCu2++Ag
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com