
����Ŀ����֪A��H����ѧ��ѧ�еij������ʣ�A��C��G�ǽ�����E��F�������B����ˮ����ɫ��Һ����������ͼ��ʾ�Ĺ�ϵ����Ӧ�����ɵ�ˮ����ȥ�����Իش��������⣮ 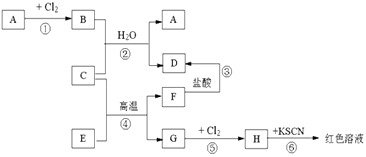
��1���ƶ���д���ʻ�ѧʽ��A�� �� D�� �� H��
��2����Ӧ�ܵĻ�ѧ����ʽΪ ��
��3���ý���C�Ʊ���һ�ֽ��������ǹ�ҵ�Ͻϳ��õķ������磺2C+4BaO ![]() 3Ba��+BaOC2O3
3Ba��+BaOC2O3
�ٳ�����C�Ľ����Ա�Ba�Ľ�������ѡ�ǿ������������
������������������ȡBa����Ҫԭ���� ��
a������ʱC�Ļ����Դ���Ba
b������������BaO�ֽ�
c������ʱBaOC2O3��C2O3�ȶ�
d������Ba�ķе�Ƚ���C�ĵ�
��4��Hˮ��Һ������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ
��5����51.2�˵�AͶ��200������������Һ��ǡ�÷�Ӧ��ȫ��������״���µ�NO2��NO��31.36L���������Ũ��molL��1 ��
���𰸡�
��1��Cu��AlCl3��FeCl3
��2��2Al+Fe2O3 ![]() Al2O3+2Fe
Al2O3+2Fe
��3������d
��4��2Fe3++2I��=2Fe2++I2
��5��15
���������⣺��1��ͨ�����Ϸ���֪��A��D��H�ֱ��ǣ�Cu��AlCl3��FeCl3 �� ���Դ��ǣ�Cu��AlCl3��FeCl3����2�������������������ȷ�Ӧ������������������Ӧ����ʽΪ��2Al+Fe2O3 ![]() Al2O3+2Fe��
Al2O3+2Fe��
���Դ��ǣ�2Al+Fe2O3 ![]() Al2O3+2Fe����3�����ɽ���Ԫ�������ڱ��е�λ�ÿ�֪Al�Ľ����Ա�Ba�������Դ��ǣ�����
Al2O3+2Fe����3�����ɽ���Ԫ�������ڱ��е�λ�ÿ�֪Al�Ľ����Ա�Ba�������Դ��ǣ�����
�ڵ�Al�ڸ����¿ɽ��������б��û�������ԭ����Ba�ķе������������ʱBaת��Ϊ�������뷴Ӧ��ϵ��ʹ��Ӧ������У����Դ��ǣ�d����4���Ȼ������������ԣ��⻯����л�ԭ�ԣ����߷���������ԭ��Ӧ�����Ȼ������͵ⵥ�ʣ���Ӧ���ӷ���ʽΪ��2Fe3++2I��=2Fe2++I2 ��
���Դ��ǣ�2Fe3++2I��=2Fe2++I2����5��n��Cu��= ![]() =0.8mol��Cu������ǡ����ȫ��Ӧ����NO2��NO�������ﻹ��Cu��NO3��2 �� ����Nԭ���غ��n��HNO3��=2n[Cu��NO3��2]+n��NOx��=2��0.8mol+
=0.8mol��Cu������ǡ����ȫ��Ӧ����NO2��NO�������ﻹ��Cu��NO3��2 �� ����Nԭ���غ��n��HNO3��=2n[Cu��NO3��2]+n��NOx��=2��0.8mol+ ![]() =3mol��c��HNO3��=
=3mol��c��HNO3��= ![]() =
= ![]() =15mol/L��
=15mol/L��
���Դ��ǣ�15��


 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ɳ�����չ������أ�����˵����ȷ����
A.������ˮʱ����������Ϊ���������Գ�ȥˮ�е�����
B.Ϊ��ֹ�����±��ȸ�֬ʳƷ�������ʣ����ڰ�װ�з�����ʯ��
C.������һ�������ڵ��������ʱ�����뾡�����ռ�����������
D.��������ֲ��ϲ������Ͻ������Ͻ�ǿ�ȴ������ᡢ����ʴ����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2ͨ��BaCl2��Һ�в���������������ͨ����һ���������Բ�����ɫ��������ͼ���Ҳ�Y�ι��з��õ�ҩƷ��ϲ�����Ҫ����ǣ���Ҫ�ǿ��Լ��ȣ��� �� 
A.Cu��Ũ����
B.CaO��Ũ��ˮ
C.����ʯ��ϡ����
D.���������Һ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2����ϩ��ʯ���ѽ�IJ���֮һ���ش��������⣺
��1���ڴ��������£�2����ϩ��������Ӧ�Ļ�ѧ����ʽΪ �� ��Ӧ����Ϊ ��
��2��ϩ��A��2����ϩ��һ��ͬ���칹�壬���ڴ�����������������Ӧ�IJ��ﲻ�������飬��A�Ľṹ��ʽΪ��A�������ܹ���ƽ���̼ԭ�Ӹ���Ϊ �� A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ռ���Ʒ�к����������������õĿ��������ʣ�Ϊ�˲ⶨ�䴿�ȣ����еζ�������
�������裺
A����250mL����ƿ������250mL�ռ���Һ
B���ü�ʽ�ζ�����ȡ25.00mL�ռ���Һ����ƿ�в��Ӽ��μ���ָʾ��
C������ƽ��ȷ��ȡ�ռ���Ʒw g�����ձ��м�����ˮ�ܽ�
D�������ʵ���Ũ��Ϊm mol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�V1 mL
E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2 mL
�������ָʾ����ɫ��Χ
ָʾ�� | ��ɫ��Χ | ��ɫ | ��ɫ |
ʯ�� | 5.0��8.0 | ��ɫ | ��ɫ |
��̪ | 8.0��10.0 | ��ɫ | ��ɫ |
���� | 3.1��4.4 | ��ɫ | ��ɫ |
������������⣺
��1��ѡ���������£�����Ͳ������ƿ���۵ζ��ܣ��ܲ�������������������ʹ��ǰ�����Ƿ�©ˮ���� �� ������ţ������������ȱ�IJ����������� ��
��2����ȷ�IJ��������ǣ���д��ĸ���������� ��
��3���ζ��ܶ���Ӧע�� ��
��4����������ƿ�µ�һ�Ű�ֽ�������� ��
��5������D��Һ��Ӧ��������
��6���ζ����յ�ʱ��ƿ����Һ��pHԼΪ���յ�ʱ����ɫ�仯�� ��
��7������ʽ�ζ���û�ñ�H2SO4��ϴ����Բⶨ����к�Ӱ�����ƫ�ߡ�����ƫ�͡�����Ӱ�족��������������ȷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����������Ŀ��
��1��д�����л�ѧ��Ӧ�����ӷ���ʽ������������Һ��������Һ��Ӧ
��̼��ƺ�����ϡ���ᷴӦ
��2�������������ӷ���ʽ����дһ�����������Ļ�ѧ����ʽ��Zn+2H+�TZn2++H2��
��HCO ![]() +H+�TCO2��+H2O
+H+�TCO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȸʯ����Ҫ�ɷ�ΪCu2��OH��2CO3 �� �����������������������������P����������ͼ1��ʵ�����Կ�ȸʯΪԭ���Ʊ��������������ͼ�� 
��ش��������⣺
��1����ҺA�еĽ��������� �� �����������Լ���ѡ��ʵ�鲽�����Լ���Ϊ������ţ�
a��KMnO4 b��HNO3c��H2O2 d��Cl2
��2������ͼ2�й����ݣ�����Ϊ��ҵ�ϼ����Լ�����������ʱӦ��ȡ�Ĵ�ʩ�ǣ���Һ�¶ȿ������棬pH������ �� ����ʱ��ΪСʱ���ң�
��3�����ⶨ��ҺA��Fe2+��Ũ�ȣ�����KMnO4����Һ�ζ�����Ӧ��MnO4����ԭΪMn2+ �� ȡA��Һ20.00mL����ȥ0.0240mol/L KMnO4��Һ16.00mLʱ��ǡ�ôﵽ�ζ��յ㣬��A��Һ��Fe2+Ũ��Ϊmol/L��
��4�������һ��ʵ�鷽��������ҺC��Fe3+�Ƿ���ȫ��ȥ��д���������衢����ͽ��ۣ� ��
��5������ҺC��õ������壬��Ҫ��������Ũ���������˵Ȳ��������ձ�©������˲������õ���һ�����������������ڴ˲����е���Ҫ������ ��
��6��Ϊ�ⶨ�����нᾧˮ��Ŀ����ȡ24.8g����ͭ����ʢװ�ڸ����
�����������ƣ���������������ٸı�ʱ��������ĩ������Ϊ16.0g���������õ�����CuSO4nH2O����n=����������ȷ��0.1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ݹ����ŵIJ�ͬ�������л�����з��ࣨ����ţ���
��CH3CH2OH �� ![]() ��CH3CH2Br ��
��CH3CH2Br �� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]()
��1������������
��2��±��������
��3��������
��4���ӣ���
��5��ȩ����
��6��ͪ����
��7�������
��8������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��������߳��ĵ����þƬ������̿Ϊ�缫�����ϵμ�ʳ��ˮ���ر�ɹ�������ط�ӦΪ2Mg+O2+2H2O=2Mg��OH��2 �� ���й��ڸõ�ص�˵��������ǣ� �� 
A.þƬ��Ϊ����
B.ʳ��ˮ��Ϊ�������Һ
C.��ع���ʱþƬ������
D.��ع���ʱʵ���˻�ѧ������ܵ�ת��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com