
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
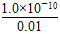 =1.0×10-8,所以CO32—浓度应大于等于
=1.0×10-8,所以CO32—浓度应大于等于 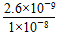 mol·L-1
mol·L-1

科目:高中化学 来源:不详 题型:填空题
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲 | [HA]=0.2 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=a |
| 乙 | [HA]=c1 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=7 |
| 丙 | [HA]=0.1 mol·L-1 | [NaOH]=0.1 mol·L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝溶于烧碱溶液:Al+2OH-=AlO2-+H2↑ |
B.用铜电极电解硫酸铜溶液:2Cu2++ 2H2O 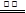 2Cu↓ +O2↑ +4H+ 2Cu↓ +O2↑ +4H+ |
C.用FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O(沸水) Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| D.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液。当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3) 2-、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B.在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子。已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32- |
| C.在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 |
| D.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
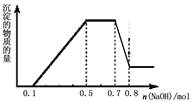
| A.溶液中一定不含CO32?,可能含有SO42?和NO3? |
| B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=[Al(OH)4 ]- |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、Mg2+、SO42—、Cl— | B.ClO—、I—、NH4+、Ba2+ |
| C.Na+、AlO2—、K+、HCO3— | D.Al3+、K+、SO42—、NO3— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
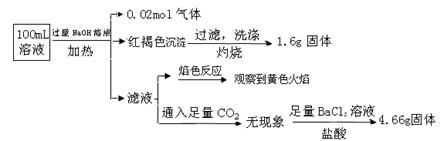
| A.原溶液中c(Fe3+)="0.2" mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
| C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 |
| D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com