
| A. | 反应②属于置换反应 | |
| B. | 反应②中氯化物的总质量保持不变 | |
| C. | 反应①、②中钛元素的化合价都改变 | |
| D. | 反应②中,氩气只作为保护气并不参加反应 |
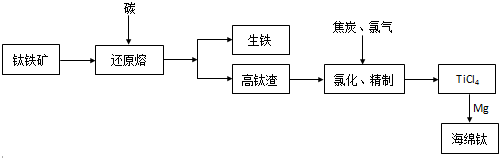
分析 A.置换反应是单质和化合物反应生成另一种单质和化合物的反应;
B.据钛的相对原子质量为48,等于两个镁原子的相对原子质量判断;
C.化合物中元素化合价的正负总数和为0,显+2价的铁元素在化合物中读作亚铁;
D.据反应②的反应条件分析回答.
解答 解:A.反应②TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2是由一种单质Mg,和一种化合物TiCl4,反应生成另一种单质Ti,和另一种化合物MgCl2,属于置换反应,故A正确;
B.化学反应前后物质的总质量不改变,钛的相对原子质量为48,等于两个镁原子的相对原子质量,所以反应前后②中氯化物的总质量保持不变,故B正确;
C.反应①中钛元素的化合价反应前后都是+4价,化合价不变;反应②中由+4价变为0价,故C错误;
D.反应②需在氩气环境中进行,这里氩气是作为保护气不参加反应,故D正确.
故选C.
点评 本题考查了氧化还原反应,题目难度不大,侧重于基础知识的考查,注意把握氧化还原反应的分析方法,考查了学生对基础知识的应用能力和分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 一定是m个 | B. | 一定是n个 | C. | 一定是(m+n)个 | D. | 可能是(m+n)个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 min时,M的转化率为80% | |
| B. | 4 min时,用M表示的反应速率为0.8 mol•L-1•min-1 | |
| C. | 4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 | |
| D. | 2 min时,M的物质的量浓度为0.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尽管NO2能与水反应生成硝酸,但NO2不属于酸性氧化物 | |
| B. | Na2O2粉末加入到FeSO4溶液中,产生白色沉淀,并放出大量气泡 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 往酸性KMnO4溶液中通入SO2验证SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 HSO3-+OH-
HSO3-+OH-| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 25℃时,向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1的CH3COONa溶液与0.1mol•L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 浓度均为0.1mol•L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60 mL的稀硫酸标准溶液,配制时应选用100 mL容量瓶 | |
| C. | 酸式滴定管用蒸馏水洗涤后,即装入稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| D. | 滴定终点时,仰视滴定管的刻度,其他操作正确,测得的NaOH溶液的浓度将偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com