
| A. | 一定是m个 | B. | 一定是n个 | C. | 一定是(m+n)个 | D. | 可能是(m+n)个 |
分析 X元素的化合价为+m价,Y元素的化合价为-n价,假设化学式为XaYb,则应满足am=nb,即满足化合价代数和为零,a、b不一定为最简单整数比,且m、n的最小公倍数不一定为mn,结合对应的实例解答该题.
解答 解:当m、n的最小公倍数为mn时,则由X和Y组成的化合物的化学式为XnYm,则一个分子含原子数目是(m+n);
当m、n的最小公倍数小于mn时,则由X和Y组成的化合物的一个分子含原子数目小于m+n,例如碳元素的化合价为+4价,氧元素的化合价为-2价,4、2的最小公倍数为4,则组成的化合物的化学式为CO2,一个分子含原子数目是3<(4+2).
故选D.
点评 本题考查原子结构与元素的性质,侧重化合价的考查,注意常见元素的化合价以及对应物质,注重相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 采用牺牲阳极的阴极保护法:在海轮外壳连接锌块保护外壳 | |
| C. | 金属在潮湿空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$ H2↑ | |
| D. | 地下钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ${\;}_{1}^{2}$H | 2He | 2Cl | Ba2+ | |
| A | 质量数 | 中子数 | 质子数 | 电荷数 |
| B | 质量数 | 质子数 | 原子个数 | 电荷数 |
| C | 质子数 | 中子数 | 原子个数 | 电荷数 |
| D | 质量数 | 质子数 | 中子数 | 电荷数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
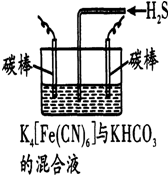 铁和铜是人类使用最早的金属,铁、铜及其化合物在工农业生产等许多领域中有着重要的作用.
铁和铜是人类使用最早的金属,铁、铜及其化合物在工农业生产等许多领域中有着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
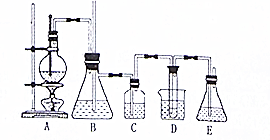 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题:
有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题: ,CB3分子的VSEPR模型为四面体形.
,CB3分子的VSEPR模型为四面体形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应②属于置换反应 | |
| B. | 反应②中氯化物的总质量保持不变 | |
| C. | 反应①、②中钛元素的化合价都改变 | |
| D. | 反应②中,氩气只作为保护气并不参加反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com