
【题目】(1)写出基态镍原子的电子排布式______.与其同周期的基态原子的M 层电子全充满的元素位于周期表的_____区; 基态原子变成激发态原子产生的光谱叫_________光谱。
(2)丙酮( )分子中2号碳原子的杂化方式为____________;与CS2互为等电子体的阴离子是____(写一种);CO32-的立体构型是________。
)分子中2号碳原子的杂化方式为____________;与CS2互为等电子体的阴离子是____(写一种);CO32-的立体构型是________。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_____mol AgCl沉淀。H2O分子的键角比H2S分子的键角大,原因是_________。
(4)如图所示为GaAs的晶胞结构。

①一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是______
②已知晶胞棱长a=5.64×10-10m.则该晶胞密度为ρ=_______。
【答案】 1s22s22p63s23p63d84s2 或[Ar]3d84s2 ds和p区 吸收 sp2杂化 N3- 平面三角形 0.2 氧的原子半径比硫小,电负性比硫大,水分子中成键电子对更靠近中心原子,相互排斥作用大,键角大 正四面体 5.37g/cm3
【解析】试题分析:(1)镍是28号元素,核外有28个电子,根据能量最低原理书写电子排布式;与镍同周期的基态原子的M 层电子全充满的元素,是29—36号元素;基态原子变成激发态原子需要吸收能量;(2)丙酮分子中2号碳原子为羰基碳原子,是平面构型,等电子体是指原子数目相同,价电子数目也相同的粒子;CO32-中碳原子的价电子对数是![]() ,无孤对电子;(3)配合物外界可以完全电离,内界不电离,[Cr(H2O)Cl]Cl2·H2O外界有2个Cl-;根据VSEPR理论和电负性差异解释H2O和H2S的键角差异;(4)①根据晶胞图分析一个镓原子周围所有距离最近且相等的砷原子形成的空间构型;②根据晶胞密度公式
,无孤对电子;(3)配合物外界可以完全电离,内界不电离,[Cr(H2O)Cl]Cl2·H2O外界有2个Cl-;根据VSEPR理论和电负性差异解释H2O和H2S的键角差异;(4)①根据晶胞图分析一个镓原子周围所有距离最近且相等的砷原子形成的空间构型;②根据晶胞密度公式![]() 计算;
计算;
解析:(1)镍是28号元素,核外有28个电子,根据能量最低原理,电子排布式是1s22s22p63s23p63d84s2;与镍同周期的基态原子的M 层电子全充满的元素,是29—36号元素,位于位于周期表的ds和p区;基态原子变成激发态原子需要吸收能量,所以基态原子变成激发态原子产生的光谱叫吸收光谱;(2)根据图示,丙酮分子中2号碳原子为羰基碳原子,是平面构型,根据杂化轨道理论,2号C原子的杂化方式应为sp2杂化;等电子体是指原子数目相同,价电子数目也相同的粒子,所以与CS2互为等电子体的阴离子,有SCN﹣、OCN-、N3-等;CO32-中碳原子的价电子对数是![]() ,无孤对电子,所以CO32-的立体构型是平面三角形;(3)配合物外界可以完全电离,内界不电离,[Cr(H2O)Cl]Cl2·H2O外界有2个Cl-,所以含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成0.2mol AgCl沉淀;氧的原子半径比硫小,电负性比硫大,水分子中成键电子对更靠近中心原子,相互排斥作用大,所以H2O分子的键角比H2S分子的键角大;(4)①根据晶胞图,一个镓原子周围所有距离最近且相等的砷原子形成的空间构型正四面体;②一个晶胞中,镓原子的数目为4,As的数目为
,无孤对电子,所以CO32-的立体构型是平面三角形;(3)配合物外界可以完全电离,内界不电离,[Cr(H2O)Cl]Cl2·H2O外界有2个Cl-,所以含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成0.2mol AgCl沉淀;氧的原子半径比硫小,电负性比硫大,水分子中成键电子对更靠近中心原子,相互排斥作用大,所以H2O分子的键角比H2S分子的键角大;(4)①根据晶胞图,一个镓原子周围所有距离最近且相等的砷原子形成的空间构型正四面体;②一个晶胞中,镓原子的数目为4,As的数目为![]() ,所以晶胞的摩尔质量是(70+75)×4,晶胞的体积是a3=(5.64×10-8)cm3=1.79×10-22 cm3,所以晶体的密度是
,所以晶胞的摩尔质量是(70+75)×4,晶胞的体积是a3=(5.64×10-8)cm3=1.79×10-22 cm3,所以晶体的密度是![]() =
=![]() 5.37g/cm3 。
5.37g/cm3 。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,请参照①-⑨在表中的位置,回答下列问题:(用元素符号或化学用语回答)

(1)由①②⑧三种元素形成的常见化合物的电子式为_____,其包含的化学键类型为_____(填“离子键”、“共价键”)。
(2)⑦和⑨能以原子个数1:2形成化合物,用电子式表示其形成过程______________。
(3)③④⑤三种元素分别形成的简单离子,离子半径由大到小的顺序是____________。
(4)③的简单氢化物的沸点比⑦的简单氢化物的沸点___(填“高”或“低”),理由_____________。
(5)元素⑥的单质和④的最高价氧化物的水化物之间发生反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:

回答下列问题:已知:①酯能被LiAlH4还原为醇
②
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
(5)参照上述合成路线,写出用甲醇和苯甲醇为原料制备化合物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验: 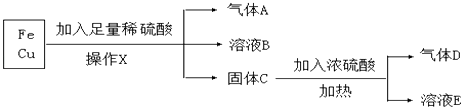
(1)操作X的名称是;
(2)气体D是;
(3)A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
(4)溶液B中的金属阳离子是 , 溶液E中阴离子除了OH﹣外还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对物质分类的归纳中,错误的是 ( )
A.空气属于化合物
B.由金属离子和酸根离子组成的化合物称为盐
C.在水溶液中能电离出氢离子的化合物不一定为酸
D.水属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在2L的密闭容器中通入4.0mol的氮气和适量的氢气,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内用氢气表示的反应速率为( )
2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内用氢气表示的反应速率为( )
A. 0.3mol/(L·s) B. 0.6mol/(L·s) C. 0.1mol/(L·s) D. 0.2mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com