
【题目】下列有关物质结构的说法正确的是( )
A. 78 g Na2O2晶体中所含阴、阳离子个数均为4NA
B. HBr的电子式为H+[![]() ∶]-
∶]-
C. PCl3和BCl3分子中所有原子的最外层都达到了8电子稳定结构
D. 3.4 g氨气中含有0.6NA个N—H键
【答案】D
【解析】本题阿伏伽德罗常数的计算与判断、电子式的书写等知识。
A.根据过氧化钠的物质的量以及过氧化钠中含有2个阳离子和1个阴离子;B.溴化氢为共价化合物,电子式中不需要标出所带电荷;C.对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构;D.根据氨气的物质的量以及1个氨气中含有3个N-H键。
解析:78gNa2O2晶体的物质的量为![]() =1mol,过氧化钠中含有2个Na+离子和1个O22—离子,78gNa2O2晶体中所含阴、阳离子个数分别为NA、2NA,故A错误;溴化氢为共价化合物,氢原子与溴原子形成了一个共用电子对,溴化氢中氢原子最外层为2个电子,溴原子最外层达到8电子,用小黑点表示原子最外层电子,则溴化氢的电子式为
=1mol,过氧化钠中含有2个Na+离子和1个O22—离子,78gNa2O2晶体中所含阴、阳离子个数分别为NA、2NA,故A错误;溴化氢为共价化合物,氢原子与溴原子形成了一个共用电子对,溴化氢中氢原子最外层为2个电子,溴原子最外层达到8电子,用小黑点表示原子最外层电子,则溴化氢的电子式为![]() ,B错误;BCl3中B元素化合价为+3,B原子最外层电子数为3,最外层有(3+3)=6,分子中B原子不满足8电子结构,故C错误;3.4g氨气的物质的量为
,B错误;BCl3中B元素化合价为+3,B原子最外层电子数为3,最外层有(3+3)=6,分子中B原子不满足8电子结构,故C错误;3.4g氨气的物质的量为![]() =0.2mol,氨气分子中含有3个N-H键,所以3.4g氨气中含有0.6NA个N-H键,故D正确。
=0.2mol,氨气分子中含有3个N-H键,所以3.4g氨气中含有0.6NA个N-H键,故D正确。


科目:高中化学 来源: 题型:
【题目】聚丙烯酸脂类涂料是目前市场流行的涂料之一,它具有不易老化、耐擦洗,色泽亮丽等优点。聚丙烯酸酯的结构简式![]() ,则下列关于它的说法中正确的是( )
,则下列关于它的说法中正确的是( )
A. 它的结构属于体型结构 B. 它的单体是CH2=CHCOOR
C. 它能做防火衣服 D. 它是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
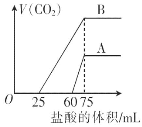
(1)原NaOH溶液的物质的量浓度为_______________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为___。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况下)的最大值为____mL。
(4)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】覆盆子酮(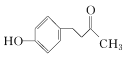 )是种从植物覆盆子中提取的较为安全的香料。一种以石油化工产A和丙烯为原料的合成路线如下:
)是种从植物覆盆子中提取的较为安全的香料。一种以石油化工产A和丙烯为原料的合成路线如下:
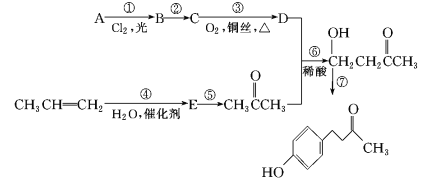
信息提示:
(ⅰ)
(ⅱ)![]()
![]()
根据上述信息回答:
(1)E的化学名称是__________。
(2)反应①的条件为____________________________。
(3)与反应⑥反应类型相同的是___________ (选填反应①~⑦, 下同),与反应③反应条件相似的是_____________。
(4)写出反应⑦的化学方程式_______________________________。
(5)E的同分异构体中,在核磁共振氢谱中出现三组峰,且峰面积之比为3∶3∶2的是___________(写出结构简式)。
(6)参照上述合成路线以丙烯为原料,设计制备CH3CH=CHCH2COCH3的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经150年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___;
(2)元素①的单质电子式为____。
(3)比较③、⑤元素的金属性强弱___>___;并写出它们最高价氧化物对应的水化物间反应的化学方程式____。
(4)上述元素的最高价氧化物对应的水化物中,酸性最强的是____。
(5)在元素③、④、⑤、⑦、⑧形成的简单离子中,半径最小的是_____;
(6)工业制取⑥的单质的反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,投入0.2mol N2和0.6 mol H2 ,发生可逆反应N2(g)+3H2(g)![]() 2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
A. 2min内H2的反应速率为0.01mol·L-1·min-1
B. 若2min后,往容器中通入0.2mol的氩气,则生成NH3的反应速率加快
C. 若混合气体的密度不再改变,则反应达到平衡状态
D. 若单位时间内有3 mol H-H键断裂,同时就有6 mol N-H键断裂,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 此物质分子式为C5H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
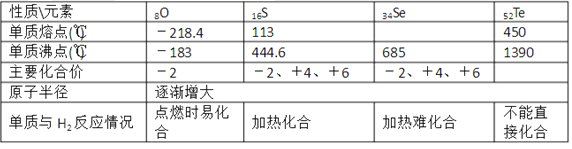
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤 | 操作 | 现象 |
I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ +![]() SO32- +
SO32- +![]() =
=![]() F e2+ +
F e2+ +![]() +
+![]()
![]()
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤 | 操作 | 现象 |
II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤 | 操作 | 现象 |
III | 向1 molL-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com