
【题目】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤 | 操作 | 现象 |
I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ +![]() SO32- +
SO32- +![]() =
=![]() F e2+ +
F e2+ +![]() +
+![]()
![]()
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤 | 操作 | 现象 |
II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤 | 操作 | 现象 |
III | 向1 molL-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
【答案】< Fe3++3H2O![]() Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3 2Fe3++SO32-+H2O
Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3 2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+ FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应” a H2SO3
2Fe2++SO42-+2H+ FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应” a H2SO3![]() H++HSO3-;HSO3-
H++HSO3-;HSO3-![]() H++SO32-,SO32-与被还原生成的Fe2+结合成FeSO3,与剩余的FeCl3溶液混合而呈现红褐色
H++SO32-,SO32-与被还原生成的Fe2+结合成FeSO3,与剩余的FeCl3溶液混合而呈现红褐色
【解析】
(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;
(2)①步骤I中溶液呈红褐色的原因是:Fe3++3H2O![]() Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3;②Fe3+→Fe2+,化合价从+3→+2,降低1价,SO32-→SO42-,化合价从+4→+6,升高2价,根据化合价升高和降低总数相等以及原子守恒配平得方程式2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;
Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3;②Fe3+→Fe2+,化合价从+3→+2,降低1价,SO32-→SO42-,化合价从+4→+6,升高2价,根据化合价升高和降低总数相等以及原子守恒配平得方程式2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;
(3)根据乙同学查阅资料得知:1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,故而乙同学认为甲同学得出结论的证据仍然不足,由是 FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”;
(4)①a.K3[Fe(CN)6]溶液与Fe2+ 会产生蓝色沉淀;b.KSCN溶液用于检验Fe3+;c.溶液中的二氧化硫会干扰KMnO4溶液检验Fe2+;②步骤III中出现红褐色的原因:H2SO3![]() H++HSO3-;HSO3-
H++HSO3-;HSO3-![]() H++SO32-,SO32-与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色。
H++SO32-,SO32-与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色。
(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O![]() Fe(OH)3+2H+,所以其溶液pH<7;
Fe(OH)3+2H+,所以其溶液pH<7;
(2)①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,原因是:Fe3++3H2O![]() Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3;
Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3;
②Fe3+→Fe2+,化合价从+3→+2,降低1价,SO32-→SO42-,化合价从+4→+6,升高2价,根据化合价升高和降低总数相等以及原子守恒配平得方程式2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;
(3)根据乙同学查阅资料得知:1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,故而乙同学认为甲同学得出结论的证据仍然不足,理由是 FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”;
(4)①a.K3[Fe(CN)6]溶液与Fe2+ 会产生蓝色沉淀,故可用于检验步骤III中红褐色溶液是否含有Fe2+,故a正确;b.KSCN溶液用于检验Fe3+,故b错误;c.溶液中的二氧化硫会干扰KMnO4溶液检验Fe2+,故c错误;答案选a;
②步骤III中出现红褐色的原因:H2SO3![]() H++HSO3-、HSO3-
H++HSO3-、HSO3-![]() H++SO32-,SO32-与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色。
H++SO32-,SO32-与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质结构的说法正确的是( )
A. 78 g Na2O2晶体中所含阴、阳离子个数均为4NA
B. HBr的电子式为H+[![]() ∶]-
∶]-
C. PCl3和BCl3分子中所有原子的最外层都达到了8电子稳定结构
D. 3.4 g氨气中含有0.6NA个N—H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、用纯净的碳酸钙粉末跟稀盐酸反应制取二氧化碳气体,请回答下列问题:
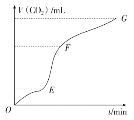
(1)实验过程如图所示,分析判断:________段化学反应速率最快。由该段图象说明:此反应属于________(填“吸热”或“放热”)反应。
(2)为了减缓上述反应的化学反应速率,欲向溶液中加入下列物质,你认为可行的是___(填字母)。
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸
(3)要减缓化学反应速率,除了上述方法外,你认为还可以采取的措施是_________。
Ⅱ、下图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。
2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。
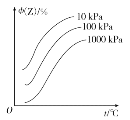
(1)若Z和X为气体,则Y为____体(填气或非气)。
(2)升高温度,v正____,v逆____(填增大或减小)。
(3)此平衡的平衡常数计算公式为:____________,温度升高,K____(填增大或减小)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铁的氧化物①FeO、②Fe2O3、③Fe3O4的下列说法中正确的是( )
A.都是黑色固体
B.都不溶于水
C.铁元素化合价都相同
D.都能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃能够发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,下列有机物可以合成环丁烷(□)的是
A. BrCH2CH2CH2CH2Br B. ![]()
C. ![]() D. CH3CH2CH2CH2Br
D. CH3CH2CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是有关各种形式能量的相互转化途径的叙述,其中错误的是( )
A.家庭液化气灶将化学能转变为热能
B.灯泡将电能全部转变为光能
C.光合作用将光能转变为化学能
D.太阳能电池将光能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的同一短同期元素,A、B是金属元素,C、D是非金属元素。
(1)A、B各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________________________________。
(2)A与C 可形成化合物A2C,该化合物的电子式为_______________________。
(3)C的低价氧化物通入D单质的水溶液中,发生反应的化学方程式为________________________________________。
(4)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_____>_____>______>______。
(5)四种元素中金属性最强的(填元素符号)______;非金属性最强的__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的工业用途不正确的是
A. 铝单质:制导线,用作冶炼锰、钨的原料
B. 钠单质:制备过氧化钠、氯化钠等
C. 碳酸氢钠:制发酵粉、治疗胃酸过多
D. 碳酸钠:制玻璃、制肥皂、制烧碱、造纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com