
【题目】卤代烃能够发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,下列有机物可以合成环丁烷(□)的是
A. BrCH2CH2CH2CH2Br B. ![]()
C. ![]() D. CH3CH2CH2CH2Br
D. CH3CH2CH2CH2Br
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,投入0.2mol N2和0.6 mol H2 ,发生可逆反应N2(g)+3H2(g)![]() 2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
A. 2min内H2的反应速率为0.01mol·L-1·min-1
B. 若2min后,往容器中通入0.2mol的氩气,则生成NH3的反应速率加快
C. 若混合气体的密度不再改变,则反应达到平衡状态
D. 若单位时间内有3 mol H-H键断裂,同时就有6 mol N-H键断裂,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)
如图所示是配制50 mL KMnO4标准溶液的过程示意图。

(1)请你观察图示判断,其中不正确的操作有__________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)配平草酸与KMnO4反应的离子方程式:__MnO+ H2C2O4+ H+=== Mn2++ CO2↑+ H2O。
(5)滴定终点时的现象是_____________________________________
(6)经过计算,血液样品中Ca2+的浓度为__________m mol·cm-3。
Ⅱ. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
实验1试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)。
操作 | 现象 |
取2 mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是_________。
(2)产生气泡的原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氡是放射性元素,氡气吸入人体有害健康。氡的原子序数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”是由质子数为86、质量数为219的原子组成。下列关于氡的说法正确的是( )
A. 氡气在标准状况下的密度 9.91 g·L-1
B. 氡气的化学性质较活泼,因此对人体有害
C. 氡原子核外有7个电子层,最外层有8个电子
D. “锕射气”是氡的同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤 | 操作 | 现象 |
I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ +![]() SO32- +
SO32- +![]() =
=![]() F e2+ +
F e2+ +![]() +
+![]()
![]()
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤 | 操作 | 现象 |
II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤 | 操作 | 现象 |
III | 向1 molL-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为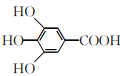 ,下列关于没食子酸的说法正确的是
,下列关于没食子酸的说法正确的是
A. 分子式为C7H7O5
B. 能发生加成反应,消去反应和取代反应
C. 1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
D. 1 mol没食子酸与足量的钠反应,生成2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一只量程为25 mL的滴定管,若液面在8.0 mL处,将溶液全部放下来,液体的体积为( )
A.17.00 mLB.大于17.00 mLC.小于17.00 mLD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中不正确的是( )
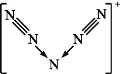
A. 每个N5+中含有35个质子和34个电子
B. 该离子中有非极性键和配位键
C. 该离子中含有4个π键
D. 与PCl4+互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 将饱和FeCl3溶液逐滴加到沸水中继续煮沸至液体呈红褐色,可制备Fe(OH)3胶体
B. 电解熔融的氯化铝,可制备铝单质
C. 加热使I2升华,可除去铁粉中的I2
D. 加入足量氨水,充分振荡、过滤,可除去硫酸铜溶液中的硫酸铝杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com