
化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C中含有苯环,且苯环上有2种氢原子。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8%,含氢7.0 %,核磁共振氢谱显示只有一个峰。

请回答下列问题:
(1)A的结构简式为_______________,G的分子式为______________。
(2)B的名称为_____________,D中官能团的名称为________________。
(3)写出F→G的化学方程式:________________________________,该反应属于_________(填反应类型)。
(4)写出满足下列条件的C的3种同分异构体的结构简式:___________________。
①是苯的对位二取代化合物;②能与FeCl3溶液发生显色反应;③不考虑烯醇( )结构。
)结构。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(写出1种即可):_________________________________________________________________。
(1) 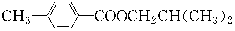 C8H12O4
C8H12O4
(2)2?甲基?1?丙醇 羧基
 取代反应(或酯化反应)
取代反应(或酯化反应)
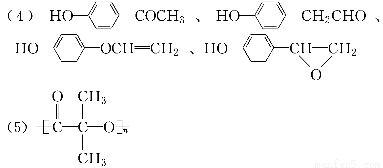
【解析】从题中转化关系可知A为酯,A(C12H16O2)+H2O―→B+C(C8H8O2),则B的分子式为C4H10O,故B为C4H9OH,B经连续氧化生成酸(D);根据信息可知,E为卤代烃,E经水解、酸化后所得的F中含有羟基和羧基。由G的组成可知,G的分子式为C8H12O4,因G分子中只有一种氢,则为F发生分子间酯化反应,形成环状酯,故F、G的结构简式为(CH3)2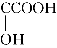 、
、 。(4)因C分子中含有苯环,且苯环上有2种氢原子,故C为对甲基苯甲酸。信息②说明C的同分异构体的苯环上的一个取代基为酚羟基,则另一取代基含两个碳原子、一个氧原子,并且不饱和度为1。(5)F发生分子间酯化反应可生成高分子化合物。
。(4)因C分子中含有苯环,且苯环上有2种氢原子,故C为对甲基苯甲酸。信息②说明C的同分异构体的苯环上的一个取代基为酚羟基,则另一取代基含两个碳原子、一个氧原子,并且不饱和度为1。(5)F发生分子间酯化反应可生成高分子化合物。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题1物质的组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列叙述正确的是( )。
A.盐酸和食醋既是化合物又是酸
B.纯碱、CuSO4·5H2O和生石灰分别属于盐、混合物和氧化物
C.胶体处于介稳定状态,所以放置一会便会有沉淀生成
D.胶体区别于其他分散系的本质特征是分散质粒子直径的大小
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题11有机化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.乙烯和聚乙烯都可与溴水发生加成反应
B.用酸性KMnO4溶液能鉴别乙烷和乙烯
C.(NH4)2SO4、CuSO4都能使蛋白质变性
D.葡萄糖、蔗糖都能与新制的Cu(OH)2反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷(解析版) 题型:实验题
某小组取一定质量的FeSO4固体,利用下图装置进行实验。

实验 | 实验过程 | 实现现象 |
① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:推断题
塑化剂是工业上被广泛使用的高分子材料助剂,在塑料加工中添加这种物质,可以使其柔韧性增强,容易加工。塑化剂可合法用于工业生产,但禁止作为食品添加剂。截止2011年6月8日,台湾被检测出含塑化剂食品已达961种,据媒体报道,2012年岁末,我国大陆多种著名品牌白酒也陷入了塑化剂风波。常见塑化剂为邻苯二甲酸酯类物质,某有机物J(C19H20O4)是一种塑料工业中常用的塑化剂,可用下列合成路线合成。

已知:Ⅰ. 

Ⅱ.控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应;
Ⅲ.F与浓溴水混合不产生白色沉淀。
请回答下列问题:
(1)E中官能团的名称为________;F中官能团的电子式为________。
(2)写出A+F―→J的化学方程式:_________________________________。
(3)写出下列化学反应类型:反应①_____________;反应④______________。
(4)写出F的属于芳香烃衍生物的同分异构体的结构简式:________________________。
(5)C4H9OH的同分异构体中属于醇类的有________种,写出其中具有手性碳的同分异构体的结构简式:____________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
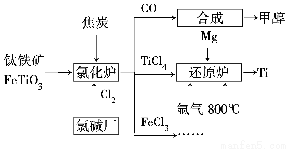
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
请填写下列空白。
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________
已知氯化炉中氯气和焦炭的理论用料物质的量之比为7∶6,则氯化炉中还原剂的化学式是___________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s)ΔH=-641 kJ/mol
②2Mg(s)+TiCl4(s)= 2MgCl(s)+Ti(s)ΔH=-512 kJ/mol
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)氩气通入还原炉中并不参与反应,通入氩气的作用是___________________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-=2CO32—+6H2O,该电池中正极上的电极反应式为_________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:

①该反应的平衡常数的表达式为K=________。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”、“等于”或“小于”)。
③在下图a、b、c三点中,H2的转化率由高到低的顺序是________(填字母)。

(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填序号)。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。


图1 图2
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填字母序号)。
A.铝B.石墨C.银D.铂
(2)N极发生反应的电极反应为 。
(3)实验过程中,S (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(Fe )在溶液中呈紫红色。
)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH- Fe
Fe +4H2O和 。
+4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少 g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:
2K2FeO4+3Zn Fe2O3+ZnO+2K2ZnO2
Fe2O3+ZnO+2K2ZnO2
该电池正极发生的反应的电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com