
【题目】下列说法错误的是( )
A.乙烯的产量是衡量一个国家石油化工发展水平的标志
B.含碳元素的化合物都是有机化合物
C.蛋白质水解最终生成氨基酸
D.乙烯、苯分子中的所有原子在同一平面上
科目:高中化学 来源: 题型:
【题目】长期缺碘和碘摄入过量都会对健康造成危害,目前加碘食盐中碘元素绝大部分以IO3-存在,少量以I-存在。现使用Na2S2O3对某碘盐样品中碘元素的含量进行测定。
I.I-的定性检测
(1)取少量碘盐样品于试管中,加水溶解。滴加硫酸酸化,再滴加数滴5%NaNO2和淀粉的混合溶液。若溶液变________色,则存在I-,同时有无色气体产生并遇空气变红棕色。试写出该反应的离子方程式为 ___________________________________。
Ⅱ.硫代硫酸钠的制备
工业制备硫代硫酸钠的反应原理为2Na2S + Na2CO3 +4SO2 =3Na2S2O3 +CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠如下图。

先关闭K1打开K2,打开分液漏斗,缓缓滴浓硫酸,控制好反应速率。
(2)y仪器名称___________ 。此时B装置的作用是___________________________。
(3)反应开始后,C中先有淡黄色浑浊,后又变为澄清,此浑浊物为____________。(填化学式)装置D的作用是____________________________________。
(4)实验结束后,关闭K2打开K1。玻璃液封管x中所盛液体最好为________(填序号)
A.NaOH溶液 B.浓硫酸 C.饱和NaHSO3溶液
Ⅲ.碘含量的测定
巳知:①称取10.00g样品,置于250mL锥形瓶中,加水100mL溶解,加2mL磷酸,摇匀。
②滴加饱和溴水至溶液呈现浅黄色,边滴加边摇,至黄色不褪去为止(约1mL)。
③加热煮沸,除去过量的溴,再继续煮沸5min,立即冷却,加入足量15%碘化钾溶液,摇匀。
④加入少量淀粉溶液作指示剂,再用0.002mol/L的Na2S2O3标准溶液滴定至终点。
⑤重复两次,平均消耗Na2S2O3溶液9.00mL
相关反应为:I-+3Br2+3H2O = IO3-+6H++6Br-
IO3-+5I-+6H+ = 3I2+3H2O
I2+2S2O32-= 2I-+S4O62-
(5)请根据上述数据计算该碘盐含碘量为_______ mg·kg—1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:

(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________
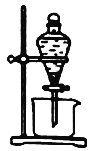
(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:
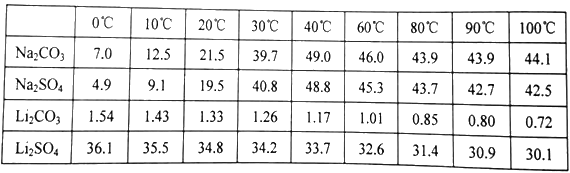
写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、![]() =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
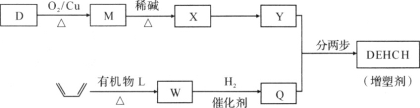
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“空气吹出法”从海水中提取溴的工艺流程如下:

下列说法不正确的是
A. 蒸馏塔中只发生了物理变化
B. 吸收塔利用了SO2的还原性,使Br2还原成Br-
C. 在吸收塔中溴元素得到了富集
D. 吹出塔中通入水蒸气,能减小Br2的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=___________。
(2)关于反应①下列说法,正确的是___________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如下图所示:

①从反应开始到5min时,生成甲醇的平均速率为___________。
②H2的平衡转化率α=___________%,化学平衡常数K=___________。
③1min时,υ正___________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正___________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小_________________________________。
③若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数___________0.1。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.测得CO的平衡转化率与压强的关系如图所示。有关说法正确的是

A. 混合气体密度:ρ(x)>ρ(w) B. 正反应速率:v正(w)>v正(y)
C. 反应温度:T2>T3 D. 混合气体的平均摩尔质量:M(y)<M(z)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com