
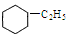 )的一溴代物共有几种(不考虑立体异构)( )
)的一溴代物共有几种(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7 | |
| C. | 若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| D. | 1.0×10-3mol•L-1盐酸的pH=3.0;1.0×10-8mol•L-1盐酸的pH=8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作、现象 | 解释 | |
| A | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| B | 向KI淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| C | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
| D | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为95% | |
| B. | Y(C2H5OH),W(C2H5ONa)可通过消去反应由Y得到W | |
| C. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 | |
| D. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去,使溶液褪色的气体只是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| B. | 在一定条件下,1molSO2和0.5molO2在密闭容器中充分反应,转移电子数目为2NA | |
| C. | 常温常压下,32gN2H4中含有的共价键数目为5NA | |
| D. | 某饱和FeCl3溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验1 | 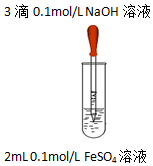 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| C. | 标准状况下,5.6L由CH4与C2H4组成的混合气体中含有的氢原子数目为6.02×1023 | |
| D. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3KJ,则其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com