
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是___________。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
方法 | 需测定的数据 |
① | 测定产生的H2的体积 |
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:___________________。
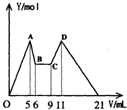
[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加amL c1 mol·L-1NaOH之后,改成滴加c2mol·L-1 HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如图所示。据此,回答下列问题:

(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则c1/c2=__________;
(2)所加入NaOH溶液的体积a=________mL。
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法正确的是( )
A.常温时将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有酸(H2SO4)溶液和盐(FeCl3)溶液
B.设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+
C.按照方案①的分类,属于碱的有Na2CO3、NaOH
D.这两组同学在研究物质性质时只使用了实验法、观察法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com