
【题目】在溶液中能大量共存,加入强碱溶液有沉淀析出,加入强酸有气体放出的是( )
A.Na+、Cu2+、Cl﹣、SO42﹣
B.Fe3+、K+、SO42﹣、NO3﹣
C.K+、Al3+、Cl﹣、CO32﹣
D.Na+、Ca2+、Cl﹣、HCO3﹣
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
【答案】 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 1s22s22p63s23p63d104s1或 3d104s1 面心立方最密堆积 O N 正四面体 sp3 高于 因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点 CuCl 
【解析】(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-; 故答案为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(2)铜是29号元素,基态原子的电子排布式为1s22s22p63s23p63d104s1,铜单质晶体中的原子堆积模型属于面心立方最密堆积,故答案为:1s22s22p63s23p63d104s1;面心立方最密堆积;
(3)上述深蓝色晶体所含的非金属元素有N、H、O、S,其中O元素的非金属性最强,电负性最大,N的2p为半充满状态,较为稳定,第一电离能最大。[Cu(NH3)4]2+形成4个配位键,具有对称的空间构型,中心原子的杂化方式为sp3,空间结构为正四面体,故答案为:O;N;正四面体;sp3;
(4)氨分子间能够形成氢键,沸点高于膦(PH3),故答案为:高于;因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点。
(5)晶胞中Cu位于顶点、面心,晶胞中Cu原子为8×![]() +6×
+6×![]() =4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4×
=4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4×![]() g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4×
g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4×![]() g,解得a=
g,解得a= cm=
cm= ×107 nm,故答案为:CuCl;
×107 nm,故答案为:CuCl;  ×107。
×107。
【题型】填空题
【结束】
12
【题目】有机物J是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:

已知:
回答下列问题:
(1)A→B的反应类型为_______________。C中的官能团名称为_____________________。
(2)D生成E的化学方程式为__________________________________。
(3)J的结构简式是_____________________。在一定条件下,H 自身缩聚生成高分子化合物的化学方程式为_______________________________________。
(4) 根据C![]()
![]() X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以乙烯和甲苯为原料,合成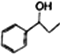 的路线流程图(其它试剂自选):__________________________________。
的路线流程图(其它试剂自选):__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOy)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)NH3催化氣化可制备硝酸。
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-907.28kJ·mol-1
4NO(g)+6H2O(g) △H1=-907.28kJ·mol-1
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2=-1269.02kJ·mol-1
2N2(g)+6H2O(g) △H2=-1269.02kJ·mol-1
则4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H3_____。
5N2(g)+6H2O(g) △H3_____。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[a(NO)]与温度、压强的关系如下图所示。则p1____p2(填“><“或“=”);

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为p2MPa。则500℃时该反
应的平衡常数Kp=______,(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_____,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为______mol。

(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,
其电解原理如图所示。

①a电极为电解池的______(填“阴”或“阳”)极,写出该电极的电极反应式:_________;电解过程中
还会生成少量氧化性极强的气体单质,该气体的分子式是_________。
②已知同温时NH3·H2O的电离常数小于氢氟酸的电离常数,则0.1mo/LNH4F溶液中所有离子浓度由大到小的顺序为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是

A. pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>>c(H+)>c(OH-)
B. 由图可知该温度下醋酸的电离平衡常数为1×10-5.75
C. pH=3.5溶液中:c(Na+)+ c(H+)-c(OH-)+c(CH3COOH)=0.05mol/L
D. 向1LW点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)+2(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学术语或表示方法不正确的是
A. S2-的结构示意图:
B. CO2的结构式:O=C=O
C. 醋酸的分子式:CH3COOH
D. 乙烯的结构简式:CH2=CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com