
| A. | 甲苯 | B. | 乙烯 | C. | 聚乙烯 | D. | 苯 |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 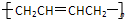 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①③④⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含53g碳酸钠的水溶液中含NA个CO32- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 一定条件下的密闭容器中,足量N2与3mol H2充分反应可生成NH3 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题:
苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com