
 mol
mol mol
mol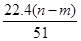 L
L ��
�� )mol
)mol| A��5�� | B��4�� | C��3�� | D��2�� |
 mol���ʢ���ȷ�������������ʱ�����ɵ�n g����Ϊ����������������þ�����������غ㶨�ɣ�����þ����Ԫ�ص���������m g�����Գ�����������������Ϊ(n��m)g����Ӧ������ת�Ƶĵ�����n(e��)��n(OH��)��
mol���ʢ���ȷ�������������ʱ�����ɵ�n g����Ϊ����������������þ�����������غ㶨�ɣ�����þ����Ԫ�ص���������m g�����Գ�����������������Ϊ(n��m)g����Ӧ������ת�Ƶĵ�����n(e��)��n(OH��)�� mol���ʢ١�����ȷ�����ݵ��ӵ�ʧ�غ�֪����״����V(NO)��
mol���ʢ١�����ȷ�����ݵ��ӵ�ʧ�غ�֪����״����V(NO)��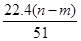 L���ʢ���ȷ���μӷ�Ӧ���������������ã����������õ�����(����������)�����ʵ������������Ƶ����ʵ�������
L���ʢ���ȷ���μӷ�Ӧ���������������ã����������õ�����(����������)�����ʵ������������Ƶ����ʵ������� mol��������������������ʵ�������NO�����ʵ�������
mol��������������������ʵ�������NO�����ʵ������� mol�����ԣ���Ͻ�Ӧ����������ʵ���Ϊ(
mol�����ԣ���Ͻ�Ӧ����������ʵ���Ϊ( ��
�� )mol���ʢ���ȷ��
)mol���ʢ���ȷ��

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ӧ��KNO3Ϊ��ԭ�� |
| B��NaN3�е�Ԫ��Ϊ��3�� |
| C����״���£�����6.5gNaN3�μӷ�Ӧ��������3.584L N2 |
| D����1mol KNO���μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ10mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| ʵ���� | �� | �� | �� | �� |
| ϡ�������(mL) | 100 | 200 | 300 | 400 |
| ʣ���������(g) | 9.0 | 4.8 | 0 | 0 |
| NO���(L) | 1.12 | 2.24 | 3.36 | V |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����6 | B����3 | C����2 | D��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


| A����Ӧ��ʼһ��ʱ���ڣ� 4-CP��������Fe2+Ũ�ȵ������������ԭ����Fe2+��ʹNa2S2O8���������SO4-���� |
| B��Fe2+��4-CP���ⷴӦ�Ĵ��� |
| C����c(Fe2+)����ʱ��4-CP�����ʷ����½���ԭ�������Fe2+����SO4����������Ӧ�����IJ���SO4������ |
| D��4-CP�����ʷ����½���ԭ����������ɵ�Fe3+ˮ��ʹ��Һ��������ǿ�������ڽ��ⷴӦ�Ľ��С� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 7N2��12H2O�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״���µ������ L��
7N2��12H2O�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״���µ������ L�� 2SO3(g) ��H��?196.6 kJ��mol�C1
2SO3(g) ��H��?196.6 kJ��mol�C1 2NO2(g) ��H��?113.0 kJ��mol�C1
2NO2(g) ��H��?113.0 kJ��mol�C1 CO2(g)����֪ij�¶��£������������ܱ������н��и÷�Ӧ�������и����ʵ���ʼŨ�ȼ������淴Ӧ���ʹ�ϵ���±���ʾ�����á���������������д���еĿո�
CO2(g)����֪ij�¶��£������������ܱ������н��и÷�Ӧ�������и����ʵ���ʼŨ�ȼ������淴Ӧ���ʹ�ϵ���±���ʾ�����á���������������д���еĿո�| ������� | c(CO)��mol��L�C1 | c(O2)��mol��L�C1 | c(CO2)��mol��L�C1 | ��(��)�ͦ�(��) ��С�Ƚ� |
| �� | 2.0��10�C4 | 4.0��10�C4 | 4.0��10�C4 | ��(��)����(��) |
| �� | 1.0��10�C3 | 4.0��10�C4 | 5.0��10�C4 | ��(��) ��(��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A���ڸ����²��ڻ� | B���ڸ����¿ɷֽ����� |
| C���ڳ����¾ͷֽ����� | D����Ϳ�ϲ����ܷ����ֽ� |

 CH4(g)+HC��CH(g)+H2(g)�� ��H1="156.6" kJ��mol-1
CH4(g)+HC��CH(g)+H2(g)�� ��H1="156.6" kJ��mol-1 CH4(g)+ HC��CH (g)����H2="32.4" kJ��mol-1
CH4(g)+ HC��CH (g)����H2="32.4" kJ��mol-1 CH3CH=CH2(g)+H2(g)�ġ�H=_____kJ��mol-1
CH3CH=CH2(g)+H2(g)�ġ�H=_____kJ��mol-1�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com