
【题目】分别将镁条和铝条平行插人盛有一定浓度稀盐酸、NaOH的烧杯中,用导线和电流计连接成两个原电池,装置如图所示。原电池工作时,下列叙述正确的是
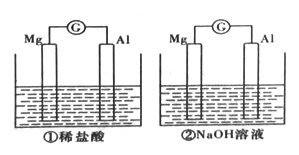
A. 因为Mg比Al活泼,所以两个原电池中负极都是Mg
B. 两个原电池中,电子都是由镁条通过导线流向铝条
C. 两个原电池中,反应放出的能量都完全转化成电能
D. 两个原电池中,正极都有氢气生成
科目:高中化学 来源: 题型:
【题目】有机物A的结构如图所示,下列说法正确的是
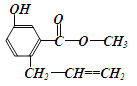
A. 一定条件下,1 mol A能与3 mol NaOH反应
B. 一定条件下,1 mol A能和5 mol氢气发生加成反应
C. 一定条件下和浓溴水反应时,1 mol A能消耗3 mol Br2
D. A能与碳酸氢钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶A和B的混合物,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm—3 | 溶解性 |
A | —11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是
A. 蒸馏 B. 蒸发 C. 分液 D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A.肉桂醛能发生加成反应、取代反应和加聚反应
B.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C.肉桂醛和苯甲醛互为同系物
D.苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:

(1)D中的含氧官能团名称为 (写两种)。
(2)F→G的反应类型为 。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式 。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式 。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化

请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图。
,写出制备的合成路线流程图。
(无机试剂任用,合成路线流程图示例见本题题干)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质。


(1)按如图装置进行实验,可观察到反应剧烈,火星四射,漏斗下方有红热熔融物“铁块”流出。
该反应的化学方程式为_____,其能量变化为如图中的______(填“A”或“B”)所示。

(2)某校化学兴趣小组同学,为了测定铝热反应后得到“铁块”混合物中铝的含量。取“铁块”样品研碎称得质量为x g,加入如图装置,再滴入足量NaOH溶液充分反应,测量生成气体体积为a ml(标况)。
①仪器A的名称为_______。
②写出样品中Al与NaOH反应的化学方程式_______。
③该小组同学改进实验,用恒压漏斗(如图)代替仪器A,其优点有________(写2点)。
④该样品中铝的含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸为弱酸,其钠盐(亚硝酸钠NaNO2)外观酷似食盐且有咸味,过量使用会使人中毒。其银盐不溶于水。某化学兴趣小组对亚硝酸钠的制备进行了探究。
(1)请设计一种简单方法鉴别NaCl和NaNO2 :___________。
(2)利用如图完成一氧化氮与过氧化钠反应制备业硝酸钠。查阅资料:2NO + Na2O2 =2NaNO2, 2NO2+ Na2O2=2NaNO3, NO 能被酸性高锰酸钾氧化为NO3-。回答下列问题:

① 检查装置气密性后,应进行的操作是_________。
② 装置B 中Cu 参与反应的离子方程式为______,装置C 的作用是______。
③ 装置E发生反应的离子方程式为________。
④ 同学们经过讨论认为上述装置仍然存在缺陷,D中生成的产物不纯,D管中可能含有的杂质为________(填化学式),你认为应该进行的改进是__________。
(3)测定制取样品中NaNO2的纯度。
步骤:a.在5个有编号的带刻度的试管中分别加入不同体积、相同浓度的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL,并振荡,制成标准色阶;
试管编号 | ① | ② | ③ | ④ | ⑤ |
NaNO2含量(mg/L) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10g制得的样品,溶于水配成500mL溶液。取5mL待测液,加入1mLM,再加入蒸馏水至l0mL,并振荡,与标准色阶比较。
比较结果:待测液与④标准色阶相同,则制取样品中NaNO2的纯度是________。
查阅资料可知:维生素C可有效降低NaNO2的含量。请完成下列实验验证方案:取5 mL 待测液,加入______,振荡,再加入1mL M溶液,_____,再振荡,与④ 标准色阶对比。实验现象为紫红色比④ 标准色阶浅,则证明维生素C可以有效降低NaNO2的含量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com