
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:2 |
分析 A、反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,应生成氧气,根据元素守恒还生成水.
B、氧化剂氧化性强于氧化产物氧化性,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+.
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍.
D、由元素化合价可知,反应中只有亚铁离子被氧化,结构电子转移守恒计算判断.
解答 解:A、反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,生成氧气,根据H元素守恒可知还生成水,故A正确;
B、氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,故B错误;
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1C12,转移电子为2mo1,故C正确;
D、由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故D正确;
故选:B.
点评 考查氧化还原反应的守恒与计算、氧化性与还原性强弱比较,难度中等,注意氧化还原反应中的守恒运用判断未知物.


科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z |
| ① | N2 | Mg | CO2 |
| ② | KOH溶液 | SiO2 | 氢氟酸 |
| ③ | O2 | N2 | H2 |
| ④ | 稀硝酸 | Fe | FeCl3溶液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
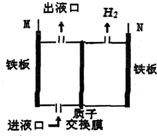 如图所示,某工厂采用电解法处理含铬(Cr2O72-)酸性废水,其中,耐酸电解槽以铁板作阴、阳极,电解后,溶液中的Cr2O72-全部变为Cr3+,下列说法不正确的是( )
如图所示,某工厂采用电解法处理含铬(Cr2O72-)酸性废水,其中,耐酸电解槽以铁板作阴、阳极,电解后,溶液中的Cr2O72-全部变为Cr3+,下列说法不正确的是( )| A. | M与电源的正极相连 | B. | 出液口排出的溶液中还含有Fe3+ | ||
| C. | N极电极反应为2H++2e-═H2↑ | D. | 阴极区附近溶液pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
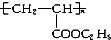 ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )| A. | 其单体是CH2=CH2和HCOOC2H5 | B. | 它是缩聚反应产物 | ||
| C. | 其链节是CH3CH2-COOC2H5 | D. | 其单体是CH2=CH-COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇燃烧 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 苯和液溴反应制备溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2+>B2+>A2+>E2+ | B. | B2+>A2+>D2+>E2+ | C. | D2+>E2+>A2+>B2+ | D. | E2+>B2+>A2+>D2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以和金属钠反应放出氢气 | |
| D. | 乙酸可以与乙醇在一定条件下发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在某恒容的密闭容器中,可逆反应A(g)+B(g)?xC(g)有如图所示的关系曲线,下列说法正确的是( )
在某恒容的密闭容器中,可逆反应A(g)+B(g)?xC(g)有如图所示的关系曲线,下列说法正确的是( )| A. | 温度:T1>T2 | B. | 压强:p1>p2 | ||
| C. | 正反应是放热反应 | D. | x的值是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
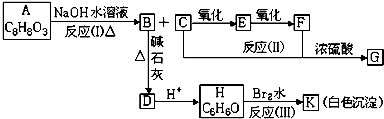
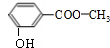 ,EHCHO.
,EHCHO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com