
【题目】将0.2mol MnO2和50mL 12molL﹣1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量的AgNO3溶液,生成AgCl的物质的量为(不考虑盐酸的挥发)( )
A.等于0.3 mol
B.小于0.3 mol
C.介于0.3~0.6 mol之间
D.以上都不正确
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示. 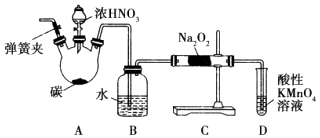
已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2﹣都能与MnO4﹣反应生成NO3﹣和Mn2+ .
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体X,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡.则X为 , 上述操作的作用是 .
(2)B中观察到的主要现象是 .
(3)A中盛装浓HNO3的仪器名称为 , A装置中反应的化学方程式为 .
(4)D装置中反应的离子方程式为 .
(5)预测C中反应开始阶段,产物除NaNO2外,还含有的副产物有Na2CO3和 . 为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为 .
(6)利用改进后的装置,将3.12g Na2O2完全转化成为NaNO2 , 理论上至少需要木炭g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如图所示,下列说法正确的是( ) 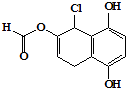
A.不能发生银镜发应
B.1mol 该物质最多可与2molBr2反应
C.1mol 该物质最多可与4mol NaOH反应
D.与NaHCO3、Na2CO3均能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物应用广泛,下列叙述正确的是( )
A. 硅酸钠可用于制备木材防火剂
B. 水晶项链是硅酸盐制品
C. 光导纤维的主要成分是晶体硅
D. 硅在地壳中主要以游离态形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然酿酒酵母菌通常缺乏分解淀粉的酶类,用作发酵原料的淀粉需经一系列复杂的转化过程才能被利用.研究者从某丝状真菌中获取淀粉酶基因并转入酿酒酵母菌,获得的酿酒酵母工程菌可直接利用淀粉产生酒精.请回答下列问题:
(1)将淀粉酶基因切割下来所用的工具是 ,用 将淀粉酶基因与载体拼接成新的DNA分子,此表达载体除目的基因外,必须含有 、 和标记基因.
(2)若要鉴定淀粉酶基因是否插入酿酒酵母菌,可采用的检测方法 ,该项方法要用 作探针进行检测;若要鉴定淀粉酶基因是否翻译成淀粉酶,可采用 方法检测.
(3)采用PCR技术可对目的基因进行体外扩增.该反应体系的主要成分应包含:扩增缓冲液(含Mg2+)、水、4种dNTP、模板DNA、引物和 .其中引物有 种,实质是 ,假如引物都用3H标记,从理论上计算循环4次,所得DNA分子中含有3H标记的占 .
(4)已知BarnHⅠ与BglⅡ的识别序列及切割位点如图所示,用这两种酶和DNA连接酶对一段含有数个BarnHⅠ和BglⅡ识别序列的DNA分子进行反复的切割、连接操作,若干循环后 序列明显增多.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1molL﹣1 Na2CO3溶液中,欲使CO32﹣的浓度尽量接近0.1molL﹣1 , 则应向溶液中加( )
A.HCl
B.Na2CO3
C.NaCl
D.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中包含的信息分析,下列叙述正确的是( ) 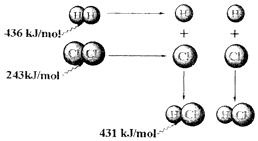
A.氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量
B.436kJ/mol是指断开1molH2 中的H﹣H键需要放出436kJ的能量
C.431kJ/mol是指生成2molHCl中的H﹣Cl键需要放出431kJ的能量
D.氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲乙两电解池. 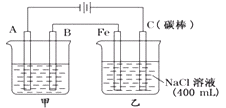
(1)甲池若为用电解原理精炼铜的装置,①A是极,材料是 , 电极反应为 , ②B是极,材料是 , 主要电极反应为 , 电解质溶液为 .
(2)写出乙池中发生的总反应的离子方程式 .
(3)若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为L.
(4)若此时乙池剩余液体为400mL,则电解后得到碱液的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3bMn(OH)2cH2O].
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 , 反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 .
(2)为测定碱式碳酸锰组成,取7.390g样品溶于硫酸,生成CO2224.0mL(标准状况),并配成500mL溶液.准确量取10.00mL该溶液,用0.0500molL﹣1EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2++H2Y2﹣=MnY2﹣+2H+),至终点时消耗EDTA标准溶液28.00mL.通过计算确定该样品的化学式.(写出计算过程) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com