
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
科目:高中化学 来源: 题型:
【题目】氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl26H2O)的过程为:

已知:Ⅰ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水;
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为__________________。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。能否用新制氯水代替双氧水________(填“能”或“否”)。
(3)在步骤②~③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为_______。
A.1.5 B.4 C.9.7 D.氧化钠
E氢氧化锶粉末 F碳酸钠晶体 G氧化锶粉末
(4)操作③中所得滤渣的主要成分是__________(填化学式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是__________。
(6)步骤⑥中,洗涤氯化锶晶体最好选用___________。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池,请利用反应“Cu +2Ag+![]() 2Ag + Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
2Ag + Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
①该电池的负极材料是 ;
②若导线上转移电子2.5mol,则正极生成银 克。
(2)现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸溶液中,A 上有气泡产生;②把C、D用导线连接后同时侵入稀硫酸溶液中,D发生还原反应;③把 A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C。根据上述情况,回答下列向题
①在①中,金属片 发生氧化反应
②在②中,金属片 作负极,
③如果把B、D用导线连接后同时侵入稀硫酸溶液,则金属片 上有气泡产生。
④上述四种金属的活动顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为
A. v(NH3)=0.010mol/(L·s)
B. v(O2)=0.0010mol/(L·s)
C. v(NO)=0.0010mol/(L·s)
D. v(H2O)=0.045mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.多糖是很多个单糖分子按照一定的方式,通过分子内脱水而结合成的
B.多糖在性质上跟单糖、双糖不同,通常不溶于水,没有甜味,没有还原性
C.淀粉和纤维素都是重要的多糖,它们的通式都是(C6H10O5)n,二者互为同分异构体
D.淀粉在稀H2SO4作用下水解最后生成葡萄糖和果糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中由水电离出来的c(OH-) =l0-12moL/L,则该溶液中的溶质不可能是 ( )
A.HC1 B.NaOH C.NH4C1 D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的做法正确的是 ( )
A. 用pH试纸测氯水的pH
B. 用托盘天平准确称取5.72 g NaCl晶体
C. 用酸式滴定管量取20.00 mL的酸性KMnO,溶液
D. 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”可能是
A.食盐 B.火碱 C.草木灰 D.胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
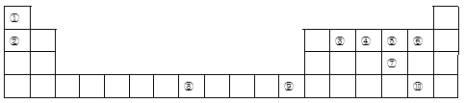
(1)比较①和②具有相同核外电子排布的简单离子半径大小关系为______________(填化学式);③、④、⑤三种元素的第一电离能由大到小的顺序为____________(填元素符号),写出原子序数和元素⑧相差2且元素⑧同族的元素基态原子的外围电子排布式____________。
(2)在元素③与①形成的原子个数比为1:1的四原子分子中,③原子的杂化方式为____________。其分子中δ键和π键数目之比为____________。
(3)元素④的某种氢化物甲分子中含有18个电子,甲为二元弱碱,在水中的电离方程式与氨相似。写出甲在水中的第一步电离的电离方程式____________。甲在微电子工业中,可作刻蚀剂H2O2的清除剂,二者发生反应的产物不污染环境,其化学方程式为____________。
(4)元素⑥和⑤形成分子乙的结构与元素①和⑤形成的最简单分子丙相似,乙的VSEPR模型为___________,解释丙的沸点高于乙的原因____________。
(5)可用赤血盐K3[Fe(CN)6]检验元素⑧的+2价阳离子,写出该反应的离子方程式___________,元素⑩的阴离子与元素⑧的+2价离子形成化合物丁,将3molCl2通入含4mol丁的溶液,用一个离子方程式表示该反应过程为____________。
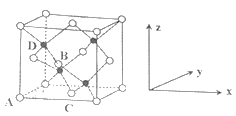
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为⑦和⑨组成的离子化合物戊的晶胞,其中三个离子(白色球)坐标参数A为(0,0,0);B为(,0,);C为(,,0)。则D离子(黑色球)的坐标参数为_____。
②晶胞参数,描述晶胞的大小和形状,已知戊的晶胞参数apm,则晶胞中B和D离子的距离为______pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com