
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是
| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO | H2O |
| ② | Fe | H2O | H2 | Fe2O3 |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
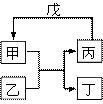
A.①③ B.②③ C.②④ D.①④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:

(1) Ⅱ中含氧官能团的名称 .
(2) 反应②的化学方程式 。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式 。
(4) 下列说法正确的是
A. Ⅰ和Ⅴ均属于芳香烃 B. Ⅱ能发生银镜反应
C. Ⅱ能与4molH2发生加成反应 D. 反应③属于酯化反应
(5) A的结构简式 。
(6) Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式 。
(7) 一定条件下,化合物Ⅶ(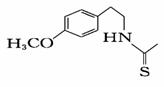 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) = MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) 的△H3= ▲ 。
(2)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为 ▲ 。
“一段脱水”的目的是制备MgCl2·2H2O,温度不高于180 ℃的原因是 ▲ 。
 ②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
③该工艺中,可以循环使用的物质有 ▲ 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:
Mg(AlH4)2=MgH2 +2A1+3H2↑
每生成27gAl转移电子的物质的量为 ▲ 。
(4)“镁-次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存的是( )。
A. Na+、CO32—、SO42—、H+ B. K+、OH—、H+、Cl—
C. Mg2+、H+、NO3—、SO42— D. Fe3+、K+、OH—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.信息产业中的光缆的主要成份是单质硅
B.NOx、CO2、PM2.5颗粒都会导致酸雨
C.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
D.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.常温下,某难溶物的Ksp为2.5×105
B.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H < 0
C.NH3•H2O溶液加水稀释后,溶液中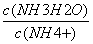 的值减小
的值减小
D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中
Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42-)≥ ▲ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 ▲ 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 ▲(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量(写出计算过程)。
▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关物质的质量分数和物质的量浓度的叙述正确的是
A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡
沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B.Na 2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10%
D.20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数
为 ×100%
×100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com