
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) = MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) 的△H3= ▲ 。
(2)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为 ▲ 。
“一段脱水”的目的是制备MgCl2·2H2O,温度不高于180 ℃的原因是 ▲ 。
 ②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
③该工艺中,可以循环使用的物质有 ▲ 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:
Mg(AlH4)2=MgH2 +2A1+3H2↑
每生成27gAl转移电子的物质的量为 ▲ 。
(4)“镁-次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为 ▲ 。
【知识点】盖斯定律、原电池、工艺流程
【答案解析】
(1)+84.6KJ/mol
①MgO;若温度太高,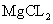 转化为MgOHCL或MgO;
转化为MgOHCL或MgO;
②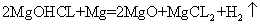 ;③HCL,
;③HCL,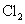
3mol
解析:(1)根据盖斯定律△H3= △H2-2△H1=-64.4kJ·mol-1-2×(-74.5kJ·mol-1)=+84.6KJ/mol
(2)①根据E中Mg元素质量分数为60.0%,得到E的化学式为MgO;观察残留固体物质的X-射线衍射谱图,若温度太高,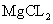 转化为MgOHCL或MgO;
转化为MgOHCL或MgO;
②MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO,化学方程式为: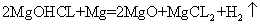 ;③用水氯镁石制备金属镁工艺的流程中看出该工艺中,可以循环使用的物质有HCL,
;③用水氯镁石制备金属镁工艺的流程中看出该工艺中,可以循环使用的物质有HCL,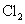 ;(3)生成27gAl,即生成1molAl转移电子的物质的量为 3mol;
;(3)生成27gAl,即生成1molAl转移电子的物质的量为 3mol;
(4)正极ClO-得电子,正极反应: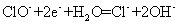
【思路点拨】本题考查盖斯定律、原电池、工艺流程等,难度不大,注意利用题中的信息解决问题。


科目:高中化学 来源: 题型:
已知元素X、Y、Z、W、R为前四周期元素,且原子序数依次增大。X基态原子核外有三个未成对电子,Z、W分别是短周期中电负性最大和最小的元素;R2+离子的3d轨道中有三对成对电子。请回答下列问题:
(1)R基态原子的电子排布式为 ,元素X、Y、Z的第一电离能由大到小的顺序为(用元素符号表示) 。
(2)化合物XZ3的空间构型为 ,R2+与NH3形成的配离子中,提供孤对电子的是 。
(3)Z的氢化物由固体变为气态所需克服的微粒间的作用力是 。
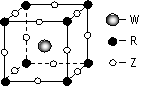 (4)Z、W、R形成某种化合物的晶胞结构如右图所示,其化学式为 。
(4)Z、W、R形成某种化合物的晶胞结构如右图所示,其化学式为 。
(5)XY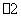 能被酸性KMnO4溶液氧化,其中MnO
能被酸性KMnO4溶液氧化,其中MnO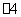 被还原为Mn2+,反应的离子方程式是 。
被还原为Mn2+,反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.250C、 101KPa条件下,1摩尔任何气体的体积都约是22.4升
B.同质量的O2和O3所含的氧原子数相同
C.同温同压下两种气体,只要分子数相同,所占体积相同,质量也相同
D.标准状况下,体积是22.4升的物质,其物质的量是1摩尔
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在SiO2晶体中1mol硅原子形成的Si-O键为2NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA

查看答案和解析>>
科目:高中化学 来源: 题型:
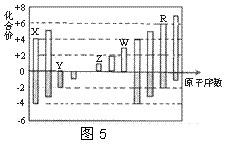
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
 A.W点所示的溶液中:
A.W点所示的溶液中:
c(CO32-)=c(HCO3-)>c(OH-)> c(H+)
B.pH=4的溶液中:
c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1 mol·L-1
C.pH=8的溶液中:
c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D.pH=11的溶液中:
c(Na+)+ c (H+)=c(OH-)+c(Cl-)+ c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
在粗盐提纯的实验中,蒸发时正确的操作是:
A.把浑浊的液体倒入蒸发皿内加热 B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热 D.蒸发皿中出现大量固体时即停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是
| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO | H2O |
| ② | Fe | H2O | H2 | Fe2O3 |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
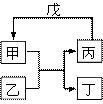
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
| 实验 装置 |
|
|
|
|
| 部分实 验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com