
分析 酸:电离出的阳离子全部是氢离子的化合物为酸;
碱:电离出的阴离子全部是氢氧根的化合物为碱;
盐:阳离子为金属离子或铵根离子,阴离子为酸根离子的化合物为盐;
电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
物质中含自由移动的电子或离子的能导电.据此分析.
解答 解:酸:电离出的阳离子全部是氢离子的化合物为酸,①HNO3电离出的阳离子全部是氢离子,故为酸;
碱:电离出的阴离子全部是氢氧根的化合物为碱,④Ba(OH)2电离出的阴离子全部是氢氧根,故为碱;
盐:阳离子为金属离子或铵根离子,阴离子为酸根离子的化合物为盐,③NH4HSO4符合盐的概念,故为盐;
电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等,①HNO3在水溶液中能导电,故为电解质,③NH4HSO4④Ba(OH)2在水溶液中和熔融状态下均能导电,故也为电解质;⑦熔融的Al2O3能导电,故为电解质;
非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等,②CH4和⑤SO3在水溶液中和熔融状态下均不能自身电离出离子而导电,故为非电解质;
物质中含自由移动的电子或离子的能导电,⑥NaCl溶液⑦熔融的Al2O3中含自由移动的离子,故能导电;⑧铜中含能自由移动的电子,故能导电.
故答案为:①;④;③;①③④⑦;②⑤;⑥⑦⑧.
点评 本题主要考查的是电解质与非电解质的概念,掌握电解质与非电解质均指的是化合物,且能导电的不一定是电解质,电解质也不一定能导电.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有CC双键的数目为3NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

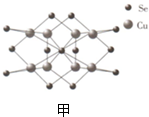

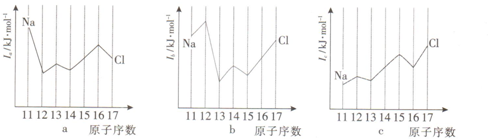
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
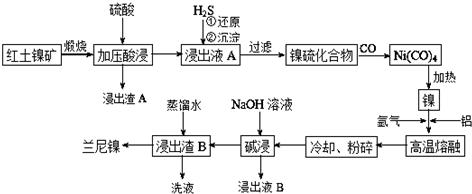
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com