
| A. | 与盐酸反应的化学方程式为:FeS2+2HCl═FeCl2+S↓+H2S↑ | |
| B. | 在FeS2中,硫元素的化合价与辉铜矿(主要成分是Cu2S)中硫元素的化合价相同 | |
| C. | FeS2中的Fe元素位于第4周期第ⅧB族 | |
| D. | 若FeS2在空气中燃烧时生成Fe2O3和SO2,则1mol FeS2在反应中将失去6mol e- |
分析 A、FeS2中硫元素化合价-1价,在酸溶液中发生自身氧化还原反应,和盐酸反应生成氯化亚铁、硫单质和硫化氢;
B、在FeS2中,硫元素的化合价为-1价,辉铜矿主要成分是Cu2S,硫元素化合价-2价;
C、铁为26号元素,位于第四周期第Ⅷ族;
D、依据FeS2在空气中燃烧时生成Fe2O3和SO2,反应中元素化合价变化结合反应的定量关系计算电子转移.
解答 解:A、FeS2中硫元素化合价-1价,在酸溶液中发生自身氧化还原反应,和盐酸反应生成氯化亚铁、硫单质和硫化氢,反应的化学方程式为:FeS2+2HCl═FeCl2+S↓+H2S↑,故A正确;
B、在FeS2中,硫元素的化合价为-1价,辉铜矿主要成分是Cu2S,硫元素化合价-2价,元素的化合价相同不同,故B错误;
C、铁为26号元素,有四个电子层,最外层电子为2个电子,位于第四周期第Ⅷ族,故C错误;
D、依据FeS2在空气中燃烧时生成Fe2O3和SO2,反应中元素化合价变化结合反应的定量关系计算电子转移,4FeS2+11O2=8SO2+2Fe2O3,4mol FeS2在反应中将失去44mol e-,1mol FeS2在反应中将失去11mol e-,故D错误;
故选A.
点评 本题考查了铁元素及其化合物性质的分析,氧化还原反应的电子转移计算,掌握反应特征和物质性质是解题关键,题目难度中等.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
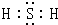 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室内着火马上开门窗 | B. | 炒菜时油锅着火用锅盖盖灭 | ||
| C. | 用明火检验燃气是否泄漏 | D. | 电器着火时用水浇灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,
,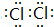 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
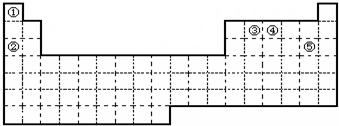
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
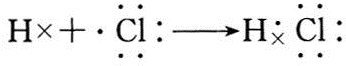 ;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程
;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程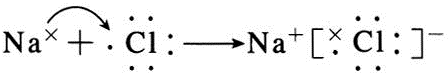 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com