
����Ŀ����֪��ɫ��ҺX���ܺ���H+��Na+��NH4+��Mg2+��Al3+��CO32-��NO3-��SO42-�еļ������ӣ�ij��ѧ��ȤС��ͨ������ʵ��ȷ������ɷ�(���������Լ������������������ת��Ϊ��״��)��
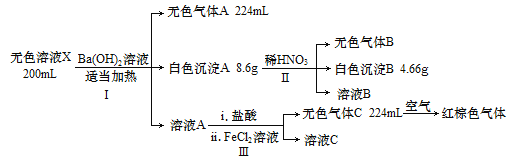
�ش��������⣺
(1)ʵ����ȷ����ɫ��ҺX��һ�������ڵ�������________��
(2)��ɫ����A�Ŀռ乹��Ϊ_______����ɫ����A�ijɷ�Ϊ_______(д��ѧʽ)��
(3)ʵ����еĵ�ii��������Ӧ�����ķ�Ӧ�����ӷ���ʽΪ________��
(4)����ɫ��ҺX��һ�����ڵ������Ӽ������ʵ���Ũ��Ϊ________��
���𰸡�H+��Mg2+��Al3+ ������ BaCO3��BaSO4 3Fe2++4H++NO3-=3Fe3++NO��+2H2O c(NH4+)=0.05mol/L��c(Na+)=0.4mol/L
��������
��ɫ��ҺX�м���Ba(OH)2��Һ���Ȳ�����ɫ����A��NH3��˵������NH4+�����ݰ��������ʵ����ɼ����NH4+�����ʵ�����ͬʱ������ɫ����A����ó����м���ϡ���������ɫ����B��ͬʱ�а�ɫ����B��˵������A��BaSO4��BaCO3�Ļ������ߵ�������Ϊ8.6g������B��BaSO4������B��CO2��˵��ԭ��Һ�к�SO42-��CO32-�����ݳ���A��B�������ɼ����ԭ��Һ�к��е�SO42-��CO32-�����ʵ���������ҺA�м��������ữ��������FeCl2��Һ��������ɫ����C���������������Ϊ����ɫ����B��NO��˵��III������������ԭ��Ӧ��A�к���NO3-������NO����������NԪ���غ�ɵ�NO3-�����ʵ������������ӹ����ж��Ƿ����������ӣ������з������
��������������֪������Һ��һ������NH4+��SO42-��CO32-��NO3-������CO32-��H+��Mg2+��Al3+�ᷢ�����ӷ�Ӧ�����ܴ������棬���Ը���Һ��һ��������H+��Mg2+��Al3+���ӣ�
(2)��ɫ����A��NH3����������ӳ������Σ���ɫ����A��BaSO4��BaCO3�Ļ���
(3) ʵ����еĵ�ii��������H+��NO3-��Fe2+����������ԭ��Ӧ�����ݵ����غ㡢����غ㼰ԭ���غ㡣�ɵø÷�Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3-=3Fe3++NO��+2H2O��
(4)�������������������֪��Ϣ�����Ԫ���غ��֪����ԭ��Һ�к��е����ӵ����ʵ����ֱ��ǣ�n(NH4+)=n(NH3)=0.224L��22.4L/mol=0.01mol��n(SO42-)=n(BaSO4)=4.66g��233g/mol=0.02mol��n(CO32-)=n(BaCO3)=(8.6-4.66)g��197g/mol=0.02mol��n(NO3-)=n(NO)= 0.224L��22.4L/mol=0.01mol�������Ӵ��еĸ�����������������Ӵ��е������������������Һ�ʵ����ԣ�˵����Һ�л�����������Na+�������ʵ�����n(Na+)=2n(SO42-)+2n(CO32-)+n(NO3-)- n(NH4+)=2��0.02mol+2��0.02mol+0.01mol-0.01mol=0.08mol����Һ�������200mL�������ɫ��ҺX��һ�����ڵ������ӵ����ʵ���Ũ��c(NH4+)= n(NH4+)��V=0.01mol��0.2L=0.05mol/L��c(Na+)= n(Na+)��V=0.08mol��0.2L=0.4mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������������۶�Ӧ��ϵ��ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��ͬ�¶��£�ͬʱ�� ��4 mL 0.1 molL-1 KMnO4������Һ����4 mL 0.2 molL-1 KMnO4������Һ�У��ֱ����4 mL 1 molL-1 H2C2O4��Һ | ������Һ����ɫ | ��ʵ�������£�KMnO4Ũ��ԽС����Ӧ����Խ�� |
B | ��ú¯�����ȵ�ú̿��������ˮ | ��������ɫ���棬ú̿ȼ�ո��� | ������ˮ��ʹú̿ȼ�շų���������� |
C | ����2NO2(g) | ��ɫ���� | ֤������Ӧ�Ƿ��ȷ�Ӧ |
D | �ֱ�ⶨ�����µ����ʵ���Ũ�ȵ�Na2SO3��Na2CO3��Һ��pH | ���߽ϴ� | ֤���ǽ����� S��C |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.NaHS��ˮ�еĵ��뷽��ʽΪNaHS��Na++HS����HS��![]() H++S2��
H++S2��
B.������ԭ��Ӧ�У�һ��Ԫ�ر�������ͬʱ������һ��Ԫ�ر���ԭ
C.1mol�����Fe(CO)5(�ʻ���)�к���5mol��λ��
D.�������������������ɣ�ͨ��ʱ���Դ����һ���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ʊ��ϳɰ�ԭ���������д��ڷ�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H����41kJ��mol��1�������ж���ȷ����
CO2(g)��H2(g) ��H����41kJ��mol��1�������ж���ȷ����
A. �÷�Ӧ���淴Ӧ�Ƿ��ȷ�ӦB. ��Ӧ��������С��������������
C. ��Ӧ������22.4LH2(g)���ų�41kJ����D. ��Ӧ������1mol CO(g)���ų�41kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A�ǾۺϷ�Ӧ�����������ϵĵ��壬�����Ϊ�ϳɵ����I����������J��ԭ�ϣ���غϳ�·�����£�

��֪��������ͼ����A������ʺɱ�Ϊ118���䱽���ϵ�һ�ȴ��ﹲ���֣��˴Ź���������
ʾ�������Ϊ3:2:2:2:1��
����������Ϣ�ش��������⣺
��1��A�Ĺ���������Ϊ__________________��B��C�ķ�Ӧ����Ϊ_____________��E��F�ķ�Ӧ����Ϊ_____________��
��2��I�Ľṹ��ʽΪ____________________����K�����к���������Ԫ��״�ṹ���������ʽΪ________________��
��3��D������������ͭ����Һ��Ӧ�����ӷ���ʽΪ_______________________________��
��4��H��ͬ���칹��W����Ũ��ˮ��Ӧ������ɫ������1 mol W���뷴Ӧ�������3 mol Br2����д�����з���������W�Ľṹ��ʽ___________________________________��
��5��J��һ�ָ߷��ӻ��������C����J�Ļ�ѧ����ʽΪ
______________________________________________________________________��
��6��![]() ��֪��
��֪��![]() ��RΪ������
��R������
����Ա�����ϩΪ��ʼԭ���Ʊ�H�ĺϳ�·�ߣ����Լ���ѡ����
[�ϳ�·��ʾ����]![]()
_____________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǶԱ�������������ʶ��һ��������Ĺ��̡�
��1�����ڱ��ĺ�̼������Ȳ��ͬ��������Ϊ����һ�ֲ���������д������ʽΪC6H6��һ�ֺ�2����������֧���IJ����������Ľṹ��ʽ��______________________________��
��2����֪����ʽΪC6H6�Ľṹ�ж��֣����е����ֽṹ��ʽΪ
��I��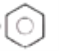 ��II��
��II��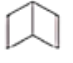
�������ֽṹ����������ڣ�
���Է���(����ѧ���ʷ���)������______________(���ţ���ѡ������)�������ܡ�
a.�����Ը��������Һ���� b.����ˮ�����ӳɷ�Ӧ
c.���巢��ȡ����Ӧ d.�����������ӳɷ�Ӧ
��������(�����ķ�Ӧ������ķ���)��1mol C6H6��H2�ӳ�ʱ������______________mol��������________________mol��
�ڽ���C6H6����������һ������ṹ(��ͼ��ʾ)���ýṹ��һ�ȴ�����____________�֡����ȴ�����_____________�֡�
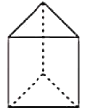
��3����Ҳ��һ�ַ����������ķ���ʽ��C10H8�������жϣ����Ľṹ��ʽ�����������е�____(����)��
a. ![]() b.
b. 
c. ![]() d.
d. 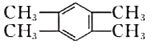
��4�����ݵڣ�3��С�������жϵõ������ṹ��ʽ�������ܽ�����������________��ʵ(����)��
a.������ʹ��ˮ��ɫ b.������H2�����ӳɷ�Ӧ
c.������������ԭ����ͬһƽ���� d.һ�����(C10H7Br)ֻ������
��5���ִ���ѧ��Ϊ��������̼̼֮��ļ���һ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ͻ�ԭ�������������й㷺ʹ�á�
��1��H3PO2���ɽ���Һ�е� Ag����ԭΪ Ag���Ӷ������ڻ�ѧ������
��H3PO2��PԪ�صĻ��ϼ�Ϊ___��
������H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�����ʵ���֮��Ϊ4��1������������Ϊ___��
��2��������һ��ǿ�ᣬ�����Ũ�ȳ���40%�ͻ�Ѹ�ٷֽ⣬��Ӧ�Ļ�ѧ����ʽΪ8HClO3��3O2����2Cl2����4HClO4��2H2O�����������������С�⣺
�ٸ÷�Ӧ�Ļ�ԭ������___(�ѧʽ)��
�����û�������ƽ����Է�������Ϊ___��
��3����֪�ⶨ�̵�һ�ַ����ǣ�������ת��Ϊ����������ӣ���Ӧ��ϵ����H����Mn2����H2O��IO3����MnO4����IO4����
���йط�Ӧ�����ӷ���ʽΪ___��
����������ת��Ϊ����������ӵķ�Ӧ�У�����ѷ�Ӧ�����Һϡ�͵�1L�������Һ��c(H��)��0.03mol/L�����ڷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦH2(g)+ ![]() O2(g)=H2O(g)�������仯��ͼ��ʾ��a��b��c��ʾ�����仯��Ϊ��ֵ����λΪkJ������˵����ȷ���� ( )
O2(g)=H2O(g)�������仯��ͼ��ʾ��a��b��c��ʾ�����仯��Ϊ��ֵ����λΪkJ������˵����ȷ���� ( )
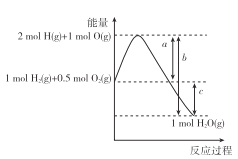
A. H2(g)+ ![]() O2(g)=H2O(g) ��H=c kJ��mol-1
O2(g)=H2O(g) ��H=c kJ��mol-1
B. 2H2O(g)=2H2 (g)+O2 (g) ��H=��2(a-b) kJ��mol-1
C. 1 mol������0.5 mol����������ΪakJ
D. 2 mol������1 mol������ȫ��Ӧ����2 molҺ̬ˮ�ų�������С��2��b-a��kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���Ӧ��N2��3H2![]() 2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1 mol H��H����1 mol N��H����1 mol N��N���ų������ֱ�Ϊ436 kJ��391 kJ��946 kJ����
2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1 mol H��H����1 mol N��H����1 mol N��N���ų������ֱ�Ϊ436 kJ��391 kJ��946 kJ����
��1����1 mol N2��ȫ��Ӧ����NH3��________(����ա��ų���)����________kJ��
��2�������1 mol N2��3 mol H2��ϣ�ʹ���ַ�Ӧ���ų���������С��������ֵ����ԭ����________________________��
��3��ʵ����ģ�ҵ�ϳɰ�ʱ�����ݻ�Ϊ2 L���ܱ������ڣ���Ӧ����10 min������10 mol NH3������N2��ʾ�Ļ�ѧ��Ӧ����Ϊ________mol��L��1��min��1��
��4��һ�������£����ϳɰ��ķ�Ӧ�ﵽ��ѧƽ��ʱ������˵����ȷ����________��
a������Ӧ���ʺ��淴Ӧ�������
b������Ӧ��������淴Ӧ����Ϊ0
c��N2��ת���ʴﵽ���ֵ
d��N2��H2��Ũ�����
e��N2��H2��NH3������������
f����Ӧ�ﵽ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com