
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
�Ҵ���һ����Ҫ�Ļ���ԭ�ϣ����Ҵ�Ϊԭ���������IJ��ֻ�����Ʒ����ͼ��ʾ��
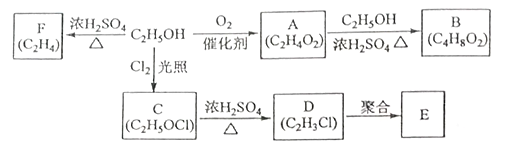
�ش��������⣺
��1��D�й����ŵ�����Ϊ_______________________________��
��2��Aת����B�Ļ�ѧ����ʽ��_____________________________��
��B��һ��̼ԭ�ӵ�B��ͬϵ����_______________��ͬ���칹�塣
��3�����Ҵ�����C�Ļ�ѧ��Ӧ����Ϊ_______________________��
��4��E��һ�ֳ��������ϣ��仯ѧ������____________________��
D��һ�������¿ɷ�����ȥ��Ӧ��д����Ӧ�Ļ�ѧ����ʽ��_________________��
��5�����Ҵ�����F�Ļ�ѧ����ʽΪ______________________��
��6������ʽΪC5H8��һ��ͬ���칹���Ǻϳ���Ȼ�ĵ��壬д����ۺϳ���Ȼ�Ļ�ѧ����ʽ__________________��
���𰸡� ̼̼˫������ԭ�� CH3COOH +CH3CH2OH ![]() CH3COOCH2CH3 + H2O 9 ȡ����Ӧ ������ϩ CH2=CHCl
CH3COOCH2CH3 + H2O 9 ȡ����Ӧ ������ϩ CH2=CHCl![]() HC��CH��+HCl�� CH3CH2OH
HC��CH��+HCl�� CH3CH2OH ![]() CH2=CH2 ��+ H2O n
CH2=CH2 ��+ H2O n![]()
![]()
![]()
������������A�ķ���ʽ�����A�����Ҵ������õ��ģ���֪AΪ����������Ҵ�����������Ӧ�õ������������Ƚ��Ҵ���C�ķ���ʽ��֪���Ҵ������е�1��Hԭ�ӱ�Clԭ��ȡ�������Է�Ӧ����Ϊȡ����Ӧ��E�ĵ���ΪD������D�ķ���ʽ����֪DΪ����ϩ������EΪ������ϩ���Ҵ���Ũ������������170 ��ʱ������ȥ��Ӧ������ϩ��ˮ��
��1��DΪ����ϩ�����Թ����ŵ�����Ϊ̼̼˫������ԭ�ӡ���2���������Ҵ�����������Ӧ�õ�������������ѧ����ʽ��CH3COOH +CH3CH2OH ![]() CH3COOCH2CH3 + H2O����B��һ��̼ԭ�ӵ�B��ͬϵ���C5H10O2��������ͬ���칹�壬
CH3COOCH2CH3 + H2O����B��һ��̼ԭ�ӵ�B��ͬϵ���C5H10O2��������ͬ���칹�壬
��Ϊ����Ͷ���������������4�֣��γɵ������ĸ���
HCOOCH2CH2CH2CH3��HCOOCH2CH��CH3��2��HCOOCH��CH3��CH2CH3��HCOOC��CH3��3��
��Ϊ����ͱ���������������2�֣��γɵ�����2����CH3COOCH2CH2CH3��CH3COOCH��CH3��2��
��Ϊ������Ҵ�������������1�֣��γɵ�����1����CH3CH2COOCH2CH3��
��Ϊ����ͼ״�������������2�У��γɵ�����2����CH3CH2CH2COOCH3����CH3��2CHCOOCH3�� ����9�֡�
��3�����Ҵ�����C���Ƚ��Ҵ���C�ķ���ʽ��֪���Ҵ������е�1��Hԭ�ӱ�Cl ԭ��ȡ�������Է�Ӧ����Ϊȡ����Ӧ��
��4��E��һ�ֳ��������ϣ�E�ĵ���ΪD������D�ķ���ʽ����֪DΪ����ϩ������EΪ������ϩ��DΪ����ϩ����һ�������¿ɷ�����ȥ��Ӧ��CH2=CHCl![]() HC��CH��+HCl����
HC��CH��+HCl����
��5�����Ҵ�����F�����Ҵ���Ũ������������170 ��ʱ������ȥ��Ӧ������ϩ��ˮ������ʽΪ��CH3CH2OH ![]() CH2=CH2 ��+ H2O ��
CH2=CH2 ��+ H2O ��
��6����Ȼ�ĵ�����![]() �������Ӿ۷�Ӧ������Ȼ������ʽΪ��
�������Ӿ۷�Ӧ������Ȼ������ʽΪ��![]()
![]()
![]() ��
��


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��R��X��Y��Z��ԭ��������������R�������̬�⻯����ӵĿռ�ṹΪ�������壬X��+1�������ӵĵ��Ӳ�ṹ����ԭ����ͬ��Ԫ��X��Z�γɻ�����G��G��X��ZԪ�ص�����֮��Ϊ 23��16����YԪ�صĿ����Ի�����E�ͺ�X�Ŀ����Ի�����F����10mL 1.0molL��1 E ��Һ�еμ�1.0molL��1 F��Һ���������������ʵ�����n����F��Һ�����V���Ĺ�ϵ��ͼ��ʾ������˵��һ����ȷ���ǣ�������
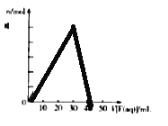
A. ԭ�Ӱ뾶��X��Y��R
B. ����������Ӧˮ��������ԣ�Z��Y��R
C. X��Y�ĵ�����ɵĻ���ﲻ����ȫ����ˮ
D. ��ҵ�ϣ�ͨ����������Ȼ����Ʊ�Y�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol/L������������Һ��0.01 mol/L�������У�ˮ�ĵ���̶ȵĴ�С��ϵ�ǣ� ��
A.ǰ�ߴ�B.ǰ��СC.һ����D.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����к��м��Թ��ۼ������ڸþ���˵���������(����)
A.�����������Ӿ���
B.�������ǵ��ʷ��ӹ��ɵľ���
C.�����Ƿ��Ӿ���
D.���ܾ��нϸߵ��۷е�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �������ȷ�Ӧ��������������һ�����ڷ�Ӧ��������
B. ʯī�ͽ��ʯ��ȫȼ�յĻ�ѧ����ʽ���ɱ�ʾΪ��C+O2![]() CO2��������ͬ�����£�12g��ʯī�ͽ��ʯ���ȼ�շų����������
CO2��������ͬ�����£�12g��ʯī�ͽ��ʯ���ȼ�շų����������
C. һ�������£�0.5 mol N2��1.5 mol H2����ij�ܱ������г�ַ�Ӧ����NH3������19.3 kJ���ݴ�ʵ����ʵ��֪���������£�ÿ����1mol NH3������19.3 kJ
D. 4 HCl(g)��O2(g)��2Cl2(g)��2H2O(g)�Ƿ��ȷ�Ӧ��Cl-Cl����O=O���ļ��ֱܷ�Ϊ243kJ/mol��498kJ/mol����������H-O���ļ��ܱ�H-Cl���ļ��ܴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͨ�뺬Fe2+��I-��Br-����Һ����Һ���������ӵ����ʵ����ı仯��ͼ��ʾ����֪b=a+5���߶���ʾһ�ֺ����ᣬ���߶�I�͢���ʾ�������к�����ͬ��Ԫ�ء�����˵���������

A. �߶�I��ʾI-�ı仯���
B. a��ʱ����Cl2�����Ϊ134.4 L
C. ԭ��Һ��n(Fe2+)��n(Br-) =2��3
D. �߶����������ԣ�C12>HIO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤��̼������Աȹ���ǿ����ʵ��
A. ������̼����ˮ���ܷ�Ӧ����̼�ᣬ�������費����ˮ������ˮ��Ӧ���ɹ���
B. �ڸ����£�����������̼�����ܷ�����Ӧ��SiO2��Na2CO3![]() Na2SiO3��CO2��
Na2SiO3��CO2��
C. ����������۵�ȶ�����̼���۵��
D. ������̼ͨ���������Һ�У����ɰ�ɫ��״����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��������Դ֮һ�����б�����ȷ����( )
A.40��ʱ����ˮ��pH��7
B.�¶����ߣ���ˮ�е�c(H��)����c(OH��)��С
C.ˮ�ĵ���̶Ⱥ�С����ˮ����Ҫ������̬��ˮ����
D.��ˮ�м��������������ˮ�ĵ��룬ʹˮ�����ӻ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ϩ�����еĻ�ѧ��������ȷ����
A. ̼ԭ�ӵ�����sp2�ӻ����������ԭ���γ������Ҽ�
B. ÿ��̼ԭ�ӵ�δ�μ��ӻ���2p����γɦҼ�
C. ÿ��̼ԭ�ӵ�sp2�ӻ�����е�����һ���γɦм�
D. ̼ԭ�ӵ�δ�μ��ӻ���2p���������ԭ���γɦҼ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com