
����Ŀ������Ҫ����ա�
��1�����и���������ԭ���������ɴ�С��˳������Ϊ������ţ�__________________��
��0.5molCO2 �ڱ�״���£�22.4L���� ��4��ʱ��18mLˮ ��0.2molH2SO4
��2������������Ϊ28%��KOHˮ��Һ�У�OH-��H2O�ĸ���֮��Ϊ__________��
��3������H2SO4��HNO3��CH3COOH��NaOH��Ba(OH)2��Cu(OH)2��ˮ��Һ�н��з�Ӧ���������ӷ���ʽH++OH��=H2O�ķ�Ӧ��__________����
��4����ҵ�������������������ռ���Һ�п����Ʊ���ˮ���������ƣ��Բ���������ѧ��Ӧ����ʽ����ƽFe(NO3)3+Cl2+NaOH����________________________________________��
��5����mg�����뺬��H2SO4��CuSO4��Һ��ȫ��Ӧ������ȫ���ܽ⣬���õ�mgͭ����μӷ�Ӧ��H2SO4��CuSO4�����ʵ���֮��Ϊ_____________��
��6��һ�������£��������ʿ���ͨ�����Ϸ�Ӧ�Ƶõ��У�д��ţ�______________________��
��С�մ� �������� ���Ȼ����� �ܴ��������� ��ͭ�̣���ʽ̼��ͭ�� ����������
��7������þ���Ͻ�10.2g����������500mL4mol/L�������г�ַ�Ӧ������ʣ�࣬����Ӧ�����Һ�м���1000mL�ռ���Һ��ʹ�ó����ﵽ���ֵ���������ռ�����ʵ���Ũ��Ϊ____mol/L��
��8��ij�����ĵ����������һ����̼�ڴ����������³�ַ�Ӧ�����ɵ����Ͷ�����̼����������ɵĵ����Ͷ�����̼�����ʵ���֮��Ϊ1:2����õ���������Ļ�ѧʽΪ_____________��
��9��п���ϡ�����ᷴӦ��������п������狀�ˮ��������amol����пʱ������ԭ����������ʵ���Ϊ______________________mol��
��10����һ������п��100mL18.5mol/LŨ�����ַ�Ӧ��п��ȫ�ܽ⣬ͬʱ����16.8��������壬����Ӧ�����Һϡ�͵�1L�������Һ��c(H+)=1mol/L����������SO2Ϊ________________mol��
���𰸡� �ۢ٢ܢ� 1:8 3 2Fe(NO3)3+3Cl2+16NaOH=2Na2FeO4+6NaNO3+6NaCl+8H2O 1:7 �٢ۢܢݢ� 2 NO 0.25a��a/4 0.6
����������1����0.5molCO2����ԭ�ӵ����ʵ���Ϊ1.5mol���ڱ�״���£�22.4L���������ʵ���Ϊ1mol����Ϊ����Ϊ��ԭ�ӷ��ӣ�����ԭ�ӵ����ʵ���Ϊ1mol�� ��4��ʱ��18mLˮ������Ϊ18g����1mol������ԭ�ӵ����ʵ���Ϊ3mol����0.2molH2SO4��������ԭ�ӵ����ʵ���Ϊ1.4mol������ԭ�Ӹ����ɴ�С��˳��Ϊ���ۢ٢ܢ���
��2����KOHˮ��Һ������Ϊ100g����KOH������Ϊ28g�����ʵ���Ϊ0.5mol��ˮ������Ϊ72g�����ʵ���Ϊ4mol������OH-��H2O�ĸ�����Ϊ0.5:4=1:8��
��3�����ӷ���ʽH++OH��=H2O��ʾ����ǿ���ǿ�Ӧ���ɿ������ε�һ���кͷ�Ӧ��������������H2SO4��NaOH�ķ�Ӧ��HNO3��NaOH�ķ�Ӧ��HNO3��Ba(OH)2�ķ�Ӧ��3������Ϊ3����
��4����Ӧ����Ԫ�صĻ��ϼ����ߣ���ClԪ�صĻ��ϼ۽��ͣ��ʻ��в���NaCl��NaNO3��H2O����ѧ����ʽΪ��2Fe(NO3)3+3Cl2+16NaOH=2Na2FeO4+6NaNO3+6NaCl+8H2O��
��5�����ݵ�ʧ�����غ���Fe����ת��ΪFe2+��ʧȥ�ĵ��ӵ����ʵ���Ϊm��56��2mol =m/28mol��Cu2+ת��ΪCu���õ��ĵ��ӵ����ʵ���Ϊm��64��2mol =m/32mol����μӷ�Ӧ��H2SO4�����ʵ���Ϊ��m/28- m/32����2mol=m/448mol������H2SO4��CuSO4�����ʵ���֮��Ϊ(m/448):(m/64)=1:7��
��6����С�մ���ɻ��Ϸ�ӦNa2CO3+CO2+H2O=2NaHCO3��ȡ���������������ɻ��Ϸ�Ӧ��ȡ�����Ȼ��������ɻ��Ϸ�Ӧ2FeCl3+Fe=3FeCl2��ȡ���ܴ������������ɻ��Ϸ�Ӧ3Fe+2O2![]() Fe3O4��ȡ����ͭ�̣���ʽ̼��ͭ�����ɻ��Ϸ�Ӧ2Cu+CO2+O2+H2O=Cu2(OH)2CO3��ȡ���������������ɻ��Ϸ�Ӧ4Fe(OH)2+O2+2H2O=4Fe(OH)3��ȡ���ʿ���ͨ�����Ϸ�Ӧ�Ƶõ��Т٢ۢܢݢ���
Fe3O4��ȡ����ͭ�̣���ʽ̼��ͭ�����ɻ��Ϸ�Ӧ2Cu+CO2+O2+H2O=Cu2(OH)2CO3��ȡ���������������ɻ��Ϸ�Ӧ4Fe(OH)2+O2+2H2O=4Fe(OH)3��ȡ���ʿ���ͨ�����Ϸ�Ӧ�Ƶõ��Т٢ۢܢݢ���
��7�������ﵽ���ֵʱ����Һ�е�����ֻ��NaCl������NaOH�����ʵ�������HCl�����ʵ�����Ϊ0.5L��4mol/L=2mol������c(NaOH)=2mol ��1L=2mol /L��
��8���赪���Ͷ�����̼�����ʵ����ֱ�Ϊ1mol��2mol����Nԭ�ӵ����ʵ���Ϊ2mol����ԭ�ӵ����ʵ���Ϊ4mol��CO�����ʵ���Ϊ2mol�����Ե����������к��е���ԭ�ӵ����ʵ���Ϊ2mol������N����������N��O�����ʵ���֮Ϊ2:2=1:1���ʻ�ѧʽΪNO��
��9������amol����п������amolZn�μӷ�Ӧ��ʧȥ�ĵ��ӵ����ʵ���Ϊ2amol��NԪ�ش�+5�۽��͵�-3�ۣ��豻��ԭ��HNO3�����ʵ���Ϊn���õ��ĵ��ӵ����ʵ���Ϊ8n�����ݵ�ʧ�����غ���8n=2a������n=a/4mol��n=0.25amol��
��10���μӷ�Ӧ����������ʵ���Ϊ1.85mol-0.5mol=1.35mol��п��Ũ���ᷴӦʱ��ʼ����SO2������������H2����������ܵ����ʵ���Ϊ16.8��22.4mol=0.75mol����SO2��H2�����ʵ����ֱ�Ϊx��y�����ݻ�ѧ����ʽCu+2H2SO4![]() CuSO4+SO2��+2H2O������SO2���ĵ���������ʵ���Ϊ2x������Zn+H2SO4=ZnSO4+H2��������H2���ĵ���������ʵ���Ϊy��������x+y=0.75��2x+y=1.35�����x=0.6mol���ʻ��������SO2�����ʵ���Ϊ0.6mol��
CuSO4+SO2��+2H2O������SO2���ĵ���������ʵ���Ϊ2x������Zn+H2SO4=ZnSO4+H2��������H2���ĵ���������ʵ���Ϊy��������x+y=0.75��2x+y=1.35�����x=0.6mol���ʻ��������SO2�����ʵ���Ϊ0.6mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������ܴ���������ǣ�������
A.K +��SiO32����OH ����Na +
B.Na +��H +��CO32����SO42��
C.K +��H +��SiO32����Cl ��
D.OH ����Na +��HCO3����Cl ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��![]() C��
C��![]() N��
N��![]() O��
O��![]() Cl��
Cl��![]() U��
U��![]() U��
U�У�
(1)___��_____����������ȣ������ܻ���Ϊͬλ�ء�
(2)____��__����������ȣ�������������ȣ����Բ���ͬһ��Ԫ�ء��������й���____��Ԫ�ء�
��.���ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ����������ӽǡ�

(1)Y�ķ���ʽΪ____��
(2)ͼ��X�ĵ���ʽΪ H![]() H������ˮ��Һ�����ڿ����з������ױ���ǣ�ԭ����____(�û�ѧ����ʽ��ʾ)���ñ仯���ֳ���S�ǽ����Ա�O____(�ǿ��������)����ԭ�ӽṹ����ԭ��ͬ����Ԫ�ش��ϵ��£�__________���õ�������������
H������ˮ��Һ�����ڿ����з������ױ���ǣ�ԭ����____(�û�ѧ����ʽ��ʾ)���ñ仯���ֳ���S�ǽ����Ա�O____(�ǿ��������)����ԭ�ӽṹ����ԭ��ͬ����Ԫ�ش��ϵ��£�__________���õ�������������
(3)Z��ͼ����ij���ʷ�Ӧ����SO2�Ļ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�е�������Ũ����50 mL 1 mol��L��1���Ȼ�����Һ�е�������Ũ����ȵ���(����)
A. 150 mL 1 mol��L��1��NaCl B. 150 mL 1 mol��L��1��KCl
C. 75 mL 3 mol��L��1��NH4Cl D. 75 mL 2 mol��L��1��CaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ����н�������ʵ�飺
���� |
|
| |
���� | Fe�������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ | Fe���������������ɫ���ݺ�Ѹ��ֹͣ | Fe��Cu�Ӵ�����������������ɫ���� |
����˵������ȷ���ǣ�������
A. ������������ɫ�����ɫ�Ļ�ѧ����ʽ��2NO+O2�T2NO2
B. ���е�����˵��Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ
C. �Դ���������˵��ϡHNO3��������ǿ��ŨHNO3
D. �������������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ�����͵����ǽ������ϣ���ҵ�Ͽ�ͨ�����·�Ӧ�ϳɣ�Al2O3+N2+ 3C![]() 2AlN+3CO������˵������ȷ����
2AlN+3CO������˵������ȷ����
A. Al2O3�Ȳ���������Ҳ���ǻ�ԭ��
B. �������뻹ԭ�����ʵ�������1��3
C. AlN�ǻ�ԭ����
D. ÿ����1 mol AlN��2mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ10mL�����ʵ���Ũ����ͬ������NaOH��Һ�зֱ�ͨ��һ������CO2�õ���Һ���ҡ���ס�������Һ�зֱ�μ�0��1 mol��L-1���ᣬ��ʱ��Ӧ����CO2�������״�������������������Ĺ�ϵ��ͼ��ʾ����������������ȷ����
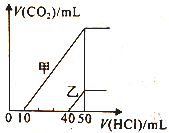
A. ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.5 mol��L-1
B. ��0<V(HCl)<10mLʱ������Һ�з�����Ӧ�����ӷ���ʽΪOH-+H+=H2O
C. ����Һ�к��е�������Na2CO3��NaHCO3
D. ����Һ�еμ���������CO2��������ֵΪ224mL����״����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com