
【题目】下列溶液中的氯离子浓度与50 mL 1 mol·L-1的氯化铝溶液中的氯离子浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl B. 150 mL 1 mol·L-1的KCl
C. 75 mL 3 mol·L-1的NH4Cl D. 75 mL 2 mol·L-1的CaCl2
科目:高中化学 来源: 题型:
【题目】下列变化中,必须加入还原剂才可以实现的是( )
A. Cl2→KClO3 B. Fe2(SO4)3→FeSO4
C. CO→CO2 D. Cu→CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下面是几种实验中常用的仪器:
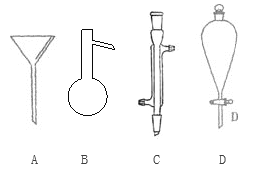
写出序号所代表的仪器的名称:
A___________;B___________;C___________;D___________。
Ⅱ.实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
⑴配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
⑵用托盘天平称取氯化钠固体,其质量为__________ g。
⑶下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
⑷如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有K+, Fe3+, Cl-,SO42-四种离子,已知K+, Fe3+, Cl-的个数比为3:2:1。则溶液中Fe3+与SO42-离子的个数比为( )
A.1:2 B.1:4 C.3:4 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是( )
A.在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B.核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C.某元素基态原子的电子排布图 ![]()
D.Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪80年代中期,科学家发现并证明碳还以新的单质形态C60存在.后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子.90年代初,科学家又发现了管状碳分子和洋葱状碳分子.(如图):下列说法错误的是( ) 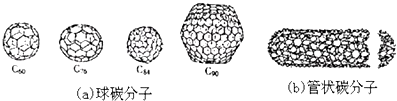
A.金刚石和石墨的熔点肯定要比C60高
B.据估计C60熔点比金刚石和石墨要高
C.无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体
D.C60的熔点低于C90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求填空。
(1)下列各物质所含原子数按照由大到小的顺序排列为(填序号)__________________。
①0.5molCO2 ②标准状况下,22.4L氦气 ③4℃时,18mL水 ④0.2molH2SO4
(2)在质量分数为28%的KOH水溶液中,OH-与H2O的个数之比为__________。
(3)仅用H2SO4、HNO3、CH3COOH与NaOH、Ba(OH)2、Cu(OH)2在水溶液中进行反应,符合离子方程式H++OH—=H2O的反应有__________个。
(4)工业上用氯气和硝酸铁在烧碱溶液中可以制备净水剂高铁酸钠,试补充完整化学反应方程式并配平Fe(NO3)3+Cl2+NaOH——________________________________________。
(5)将mg铁粉与含有H2SO4的CuSO4溶液完全反应,铁粉全部溶解,并得到mg铜,则参加反应的H2SO4与CuSO4的物质的量之比为_____________。
(6)一定条件下,下列物质可以通过化合反应制得的有(写序号)______________________。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(7)现有镁铝合金10.2g,将其置于500mL4mol/L的盐酸中充分反应后无金属剩余,若向反应后的溶液中加入1000mL烧碱溶液,使得沉淀达到最大值,则加入的烧碱的物质的量浓度为____mol/L。
(8)某常见的氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得生成的氮气和二氧化碳的物质的量之比为1:2,则该氮的氧化物的化学式为_____________。
(9)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成amol硝酸锌时,被还原的硝酸的物质的量为______________________mol。
(10)将一定量的锌与100mL18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成16.8升标况气体,将反应后的溶液稀释到1L,测得溶液中c(H+)=1mol/L,则气体中SO2为________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。
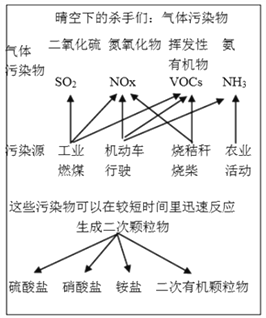
(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_______________。
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______________。
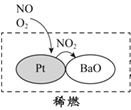
(3)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
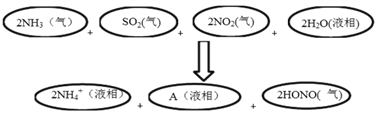
请判断A的化学式并说明判断理由:_____________________________________________。
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42 | NO3 | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.0×104 | 3.4×103 |
①SO2和NaClO2溶液反应的离子方程式是________________________________________。
②表中y =_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 升甲气体和2 升乙气体恰好完全化合生成2 升丙气体(同温同压),若丙气体的分子式为YX2,则甲和乙的分子式依次为
A.X2 与Y2 B.XY 与X2 C. X2 与YX D.YX 与Y2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com