
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
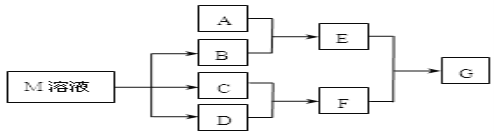
(1)写出用惰性电极电解M溶液的离子方程式____________。写出F的电子式____________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是___________________。
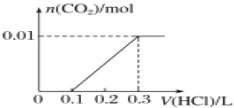
(3)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如图所示,“则A与B溶液”反应后溶液中的溶质为______________(填化学式)。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所能观察到的实验现象是___________________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚后溶液显紫色,则由A转化成E的离子方程式是__________;
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,请写出足量E与D反应的化学方程式________________。
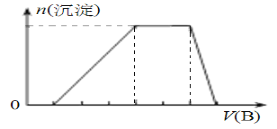
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_______________________。
【答案】(1)2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑(2分);
2OH﹣+H2↑+Cl2↑(2分);![]() (1分);
(1分);
(2)水玻璃或泡花碱(2分);
(3)Na2CO3和NaHCO3(2分);
(4)溶液中有白色絮状沉淀生成且不断增加;然后沉淀逐渐溶解最后消失(2分);
(5)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓(2分)
[或Fe2++2OH﹣=2Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3)];
(6)3Cl2+8NH3=N2+6NH4Cl;(2分)
(7)c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3(2分)
【解析】
试题分析::(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,用惰性电极电解M溶液的离子方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,HCl分子中H原子与Cl原子之间形成1对共用电子对,其电子式为:
2OH-+H2↑+Cl2↑,HCl分子中H原子与Cl原子之间形成1对共用电子对,其电子式为:![]() ;
;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3,E的溶液俗称水玻璃;
(3)若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,根据反应后所得的溶液再与盐酸反应产生气体的图2所示可知,盐酸体积为0.1L时没有气体,而用了0.2L的盐酸产生气体,碳酸钠溶液生成碳酸氢钠的用掉的盐酸与碳酸氢钠产生二氧化碳用的掉的盐酸相等,由此判断反应后溶液中的溶质为Na2CO3和NaHCO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失;
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3,则由A转化成E的离子方程式是:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓;
(6)若A是一种化肥,实验室可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl;
(7)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1积,
发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,
发生反应NH4++OH-=NH3H2O,铵根消耗氢氧化钠为2体积,
则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,
n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3。


科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无 色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O

(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
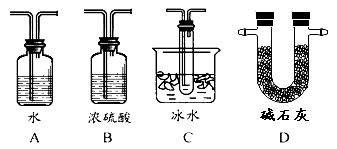
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将其序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用12.6gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了4.48g,则实验测得SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】猫头鹰体内有A种蛋白质,20种氨基酸;田鼠体内有B种蛋白质,20种氨基酸。猫头鹰捕食田鼠一小时后其消化道中的小肠上皮细胞中含有蛋白质种类和氨基酸种类最可能是( )
A. A+B,40 B. A,20 C. >A,20 D. <A,20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行如下反应:2X(g) + Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA
B.1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA
C.2.0g H218O与D2O的混合物中所含中子数为NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3﹣物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5 △H1
2H2(g)+O2(g)=2H2O(g)△H2
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为______(用△H1、△H2、△H3表示)
A.12△H3+5△H2-2△H1 B.2△H1 -5△H2- 12△H3
C.12△H3-5△H2-2△H1 D.△H1 -5△H2 -12△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com