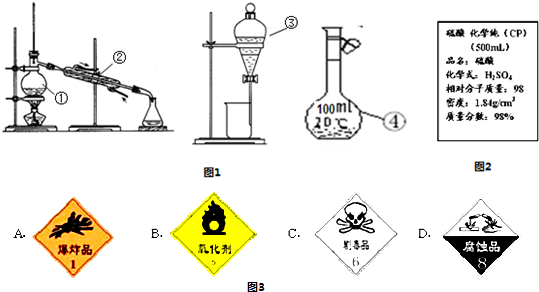
分析:(1)由图中仪器的结构可知,①为蒸馏烧瓶、②是冷凝管、③是分液漏斗、④是100mL容量瓶;
(2)分液漏斗和100mL容量瓶在使用前要检查是否漏水;
(3)萃取利用溶质在不同溶剂中溶解度不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来,然后分液;
根据碘与四氯化碳的沸点不同可用蒸馏分离;
萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
(4)a、根据配制溶液的实验操作过程选择所需的仪器;
b、根据c=
计算浓H
2SO
4的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积.
根据所需浓硫酸的体积选择量筒规格;
c、分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
分析判断.
解答:解:(1)由图中仪器的结构可知,①为蒸馏烧瓶、②是冷凝管、③是分液漏斗、④是100mL容量瓶,
故答案为:蒸馏烧瓶;冷凝管;分液漏斗;100mL容量瓶;
(2)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,
故答案为:③④;
(3)碘在四氯化碳中的溶解度较在水中大,并且四氯化碳和水互不相溶,可用萃取的方法分离,接着可用分液方法将两层液体分开,故分离碘水中的碘应选择装置II;
四氯化碳易挥发,可用蒸馏的方法分馏得到四氯化碳,分离碘与四氯化碳;
碘在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和碘不反应,故选②③,
故答案为:II;蒸馏;②③;
(4)a、没有480mL容量瓶,选择500mL容量瓶.
操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
由提供的仪器可知还需要仪器有:500mL容量瓶、玻璃棒;
故答案为:500mL容量瓶、玻璃棒;
b、浓H
2SO
4的物质的量浓度c=
mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,
所以xmL×18.4mol/L=500mL×1mol/L,解得:x≈27.2,
所需浓硫酸的体积为27.2mL.量筒规格越接近所需浓硫酸体积误差越小,所以选择50mL量筒,
故答案为:27.2;B;
c、A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸,量取浓硫酸的体积增大,所配溶液浓度偏高,故A符合;
B.定容时,俯视容量瓶刻度线,液面在刻度线以下,导致所配溶液体积减小,所配溶液浓度偏高,故B符合;
C.溶液有热胀冷缩的性质,浓硫酸稀释,放出大量的热,溶解后未恢复室温立即转移到容量瓶中定容,导致所配溶液体积减小,所配溶液浓度偏高,故C符合;
D.转移溶液时,不慎有少量溶液洒到容量瓶外面,移入容量瓶中的溶质硫酸的物质的量减小,所配溶液浓度偏低,故D不符合;
E.最后需要加水定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故E不符合;
F.摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低,故F不符合;
故选:ABC.





 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案