
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
①天然气②煤③核能④水力发电⑤太阳能⑥燃料电池⑦风能⑧氢能
A. ①②③④ B. ③⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】在某温度时,将n molL-1氨水滴入10mL1.0 molL-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如右图所示,下列有关说法正确的是( )
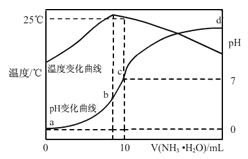
A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:C(NH4+)>C(Cl-)>C(H+)>C(OH-)
D. 25℃时NH4Cl水解常数为(n-1)×10-7molL-1(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
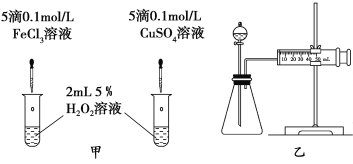
①定性分析:如图甲可通过观察__________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是 ,实验中需要测量的数据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016-2017学年辽宁省重点高中协作校高二上学期期中化学卷】电离度是描述弱电解质电离程度的物理量,电离度=(己电离的物质的量/原来的总物质的量)X 100%。现取20 mL pH=4的CH3COOH溶液,加入0.2 mol L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为
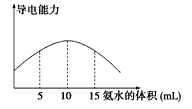
A.0.5% B.0.1% C.1.5% D.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,已知0.1mol﹒L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。
① 常温下,0.1 mol﹒L-1 HA溶液的pH=_________;设计一个简单实验证明HA是强酸还是弱酸_________。
② pH=3的HA与pH= 11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:______________。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH______________14—a (>、<、=)
(3)向物质的量浓度均为0.01 mol﹒L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是______________,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。
(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)己知常温下CH3COOH的电离平衡常数为1.7×10-5,则该温度下CH3COO-的水解平衡常数等于____________(保留小数点后两位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【陕西省榆林市2017届高考模拟第一次测试理综】常温下,各取1mL PH=2的两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
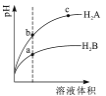
A. H2A的酸性比H2B弱
B. c点溶液的导电性比a,b点溶液的导电性都强
C. 若0.1mol/LNaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A) >c(H+)>c(OH-)
D. Na2B的水溶液中,离子浓度大小为试卷c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应中属于放热反应的是
A. 氢氧化钾与硝酸反应 B. 焦炭在高温下与水蒸气反应
C. 石灰石分解成氧化钙和二氧化碳 D. Ba(OH)2·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是 ( )
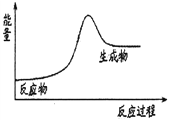
A. 放热反应在常温下一定很容易发生
B. 化学反应一定既伴随着物质变化又伴随着能量变化
C. 石灰石分解反应的能量变化可以用右图3表示
D. 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
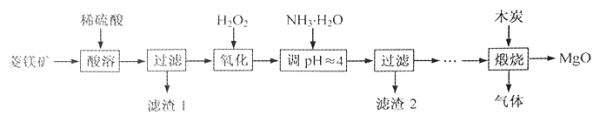
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分布吸收或收集。
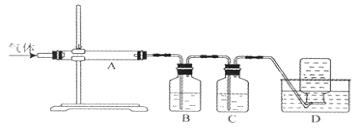
①D中收集的气体是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH溶液 B.Na2CO3溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com