
【题目】关于下列装置说法正确的是( ) 
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
【答案】B
【解析】解:A、在装置①中,金属锌是负极,金属铜是正极,盐桥中的K+移向CuSO4溶液,故A错误;
B、在电解池装置②的阴极上是阳离子氢离子发生得电子的还原反应,氢离子浓度减小,所以a极附近溶液的pH增大,故B正确;
C、电解精炼铜时,电解池的阳极是粗铜,阴极时精铜,即c极为精铜,故C错误;
D、在金属的电化学腐蚀中,金属锌是负极,金属铁是正极,电子是从负极Zn流向正极Fe,装置中铁电极上会产生氢气,故D错误.
故选:B.
A、在原电池中,电解质中的阳离子移向正极;
B、在电解池的阴极上是阳离子发生得电子的还原反应;
C、电解精炼铜时,电解池的阳极是粗铜;
D、在金属的电化学腐蚀中,电子是从负极流向正极,根据电极反应来判断即可.


科目:高中化学 来源: 题型:
【题目】温度时,用惰性电极电解硝酸钠的不饱和溶液.若两极板收集到气体总体积为22.4aL时,剩余溶液恢复至原温度,析出溶质mg(溶质不带结晶水);若两极收集到气体总体积为33.6aL时,剩余溶液恢复至原温度,析出溶质ng.则硝酸钠在该温度时的溶解度是(气体体积均已折合为标准状况下的体积)( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。
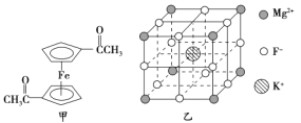
【答案】 1s22s22p63s23p63d5(或3d5) sp3、sp2 N>O>C CO(或N2) 4∶3 KMgF3
【解析】(1)Fe的原子序数为26,Fe3+的基态核外电子排布式为1s22s22p63s23p63d5(或3d5)。
(2)根据图中乙酰基二茂铁的结构可知,碳原子的杂化方式有两种。其中形成碳氧双键的碳原子和五元环上的碳原子杂化方式是sp2杂化,而-CH3上的碳原子杂化方式是sp3杂化。
(3)根据元素周期律,可知同周期元素原子第一电离能随着原子序数的增加逐渐增大,由于原子轨道上电子处于全满、半满和全空时较稳定,所以第ⅡA、ⅢA族以及第ⅤA、ⅥA主族存在反常,即同周期元素第ⅡA族的第一电离能大于第ⅢA族的第一电离能,第ⅤA族的第一电离能大于第ⅥA族的第一电离能,因此![]() 、
、![]() 、
、![]() 原子的第一电离能由大到小的顺序是N>O>C。
原子的第一电离能由大到小的顺序是N>O>C。
(4)配合物K3Fe(CN)6的配体是CN-,有14个电子,因此与其互为等电子体的分子有两种:CO或N2;(CN)2是直线型分子且具有对称性,可以判断碳氮之间形成三键,碳碳之间为单键连接,其结构式为N≡C-C≡N,因此![]() 键有4个,
键有4个,![]() 键有3个,个数比为
键有3个,个数比为![]() 。
。
(5)由晶胞结构图可知:K+位于体心,F-位于棱上,Mg2+位于顶点,因此每个晶胞中有1个K+、1/4×12=3个F-,1/8×8=1个Mg2+,则该晶体的化学式为KMgF3。
【题型】综合题
【结束】
12
【题目】某树脂的合成线路如下:
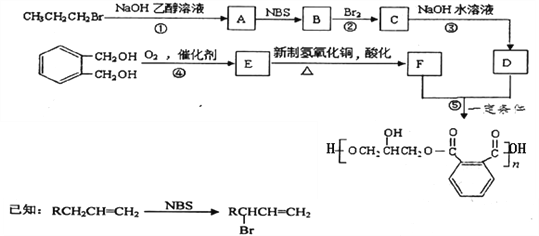
(1)B中含有的官能团的名称是________________________。
(2)反应①、③的有机反应类型分别是________________、____________________。
(3)检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是_______________。
(4)下列说法正确的是__________(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2mol Ag
b.可以用NaHCO3鉴别E和F
c.B分子存在顺反异构
(5)写出反应⑤的化学方程式______________________________________________。
(6)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.氯气不溶于水,因此可用排水法收集氯气
B.新制氯水可以使干燥的有色布条褪色
C.因为氯气具有刺激性气味,所以可以杀灭细菌和病毒
D.液氯比氯水的漂白作用更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法正确的是 ( )
A. 由反应可确定:氧化产物是HClO4
B. 由非金属性Cl>S,可推知酸性HClO3>H2SO4
C. 若化学计量数a=8,b=3,则该反应转移电子数为8e-
D. 若该反应所得lmol混合气体质量为45g,则反应可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式________。
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子中含有的化学键是________。
a.配位键 b.离子键 c. ![]() 键 d.
键 d. ![]() 键
键
②乙二胺分子中氮原子的杂化轨道类型为________,C、N、H三种元素的电负性由大到小顺序是________。
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是________。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是________。
(4)Cu和S形成某种晶体的晶胞如图所示。

①该晶体的化学式为________。
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为________。
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏加德罗常数值为NA。列式表示该晶体中原子的空间利用率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),△H=﹣1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
A.
B.
C.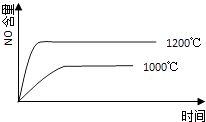
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com