
����Ŀ������ѧ��ѡ��3�����ʽṹ�����ʡ�ͭ����Ҫ�Ĺ���Ԫ�أ��䵥�ʼ���������й㷺��;���ش��������⣺
��1��ͭԪ�ػ�̬ԭ�ӵļ۵����Ų�ʽ________��
��2��ͭ���γɶ���������Cu2�����Ҷ�����H2N-CH2-CH2-NH2�����γ���ͼ��ʾ�����ӡ�

��Cu2�����Ҷ������γɵ��������к��еĻ�ѧ����________��
a����λ�� b�����Ӽ� c�� ![]() �� d��
�� d�� ![]() ��
��
���Ҷ��������е�ԭ�ӵ��ӻ��������Ϊ________��C��N��H����Ԫ�صĵ縺���ɴ�С˳����________��
���Ҷ��������װ�[N(CH3)3]�����ڰ����Ҷ����ķе�����װ��ߺܶ࣬ԭ����________��
��3��Cu2+��ˮ��Һ����[Cu(H2O)4]2+��ʽ���ڣ���Cu2+����Һ�м���������ˮ�������ɸ��ȶ���[Cu(NH3)4]2+����ԭ����________��
��4��Cu��S�γ�ij�־���ľ�����ͼ��ʾ��

�ٸþ���Ļ�ѧʽΪ________��
�ڸþ���ԭ���������AΪ(0��0��0)��BΪ(1��0��0)����Cԭ�ӵ��������Ϊ________��
����֪�þ�����ܶ�Ϊd g��cm��3��Cu2+��S2���İ뾶�ֱ�Ϊa pm��b pm�������ӵ�����ֵΪNA����ʽ��ʾ�þ�����ԭ�ӵĿռ�������________��
���𰸡� 3d104s1 ac sp3 N>C>H �Ҷ������Ӽ���γ������ ���װ����Ӽ䲻���γ���� N Ԫ�ص縺�Ը�С�� �������¶Ե����γ���λ�� CuS ![]()
![]()
����������1��ͭ��29��Ԫ�أ���̬ͭԭ�ӵļ۵����Ų�ʽΪ3d104s1����4����Cu2+���Ҷ����γɵ�������Ϊ![]() ��������֮�������λ�������⣬̼��֮����ڼ��Լ���̼̼֮����ڷǼ��Լ����Ҷ���������N����H��λ�����ۼ���Ϊ��������
��������֮�������λ�������⣬̼��֮����ڼ��Լ���̼̼֮����ڷǼ��Լ����Ҷ���������N����H��λ�����ۼ���Ϊ��������![]() ����������
����������![]() ������ѡac�����Ҷ��������е�ԭ���γ�4���ļ����۲���Ӷ���Ϊ4����ԭ��Ϊsp3�ӻ���C��N��H����Ԫ�أ�������������Խǿ��Ԫ����縺��Խ����������������С˳����N��C��H��������縺�Դ�С˳����N��C��H�����Ҷ��������װ�[N(CH3)3]�����ڰ����Ҷ����ķе�����װ��ߺܶ࣬ԭ�����Ҷ������Ӽ���γ������ ���װ����Ӽ䲻���γ��������3��Cu2+��ˮ��Һ����[Cu(H2O)4]2+��ʽ���ڣ���Cu2+����Һ�м���������ˮ�������ɸ��ȶ���[Cu(NH3)4]2+����ԭ����N Ԫ�ص縺�Ը�С�� �������¶Ե����γ���λ������4���ٸ��ݾ�̯���ɵþ�����Cuԭ�Ӹ���Ϊ
������ѡac�����Ҷ��������е�ԭ���γ�4���ļ����۲���Ӷ���Ϊ4����ԭ��Ϊsp3�ӻ���C��N��H����Ԫ�أ�������������Խǿ��Ԫ����縺��Խ����������������С˳����N��C��H��������縺�Դ�С˳����N��C��H�����Ҷ��������װ�[N(CH3)3]�����ڰ����Ҷ����ķе�����װ��ߺܶ࣬ԭ�����Ҷ������Ӽ���γ������ ���װ����Ӽ䲻���γ��������3��Cu2+��ˮ��Һ����[Cu(H2O)4]2+��ʽ���ڣ���Cu2+����Һ�м���������ˮ�������ɸ��ȶ���[Cu(NH3)4]2+����ԭ����N Ԫ�ص縺�Ը�С�� �������¶Ե����γ���λ������4���ٸ��ݾ�̯���ɵþ�����Cuԭ�Ӹ���Ϊ![]() ��Sԭ�Ӹ���Ϊ4���ʾ���Ļ�ѧʽΪCuS���ڸ��ݸ���ԭ�ӵ����λ�ÿ�֪��D�ڸ��������1/4����������������
��Sԭ�Ӹ���Ϊ4���ʾ���Ļ�ѧʽΪCuS���ڸ��ݸ���ԭ�ӵ����λ�ÿ�֪��D�ڸ��������1/4����������������![]() ������֪�þ�����ܶ�Ϊd g��cm��3��Cu2+��S2���İ뾶�ֱ�Ϊa pm��b pm�������ӵ�����ֵΪNA��һ��������ԭ�ӵ����Ϊ
������֪�þ�����ܶ�Ϊd g��cm��3��Cu2+��S2���İ뾶�ֱ�Ϊa pm��b pm�������ӵ�����ֵΪNA��һ��������ԭ�ӵ����Ϊ![]() ��һ�����������Ϊ
��һ�����������Ϊ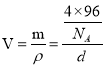 ���ʾ�����ԭ�ӵĿռ�������Ϊ
���ʾ�����ԭ�ӵĿռ�������Ϊ ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҺX�н����ܺ���K+��Na+��Fe2+��Fe3+��SO42-��CO32-��I-��Cl-�е�һ�ֻ���֣�����Һ�и�����Ũ����ͬ���ֽ�������ʵ�飬����˵����ȷ���ǣ� ��
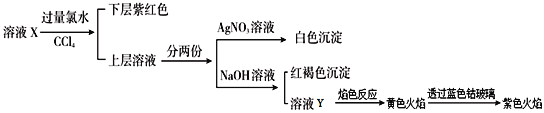
A. ����ҺX��Na+��Cl-һ����
B. ��ҺY�м����Ȼ�����Һû�г���
C. ����Һ�����������������⻯�غ��Ȼ�������ˮ��õ���
D. ԭ��ҺX�еμӼ���KSCN��Һ���ٵμ������Ĵ���������Һ����Һ��Ѫ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��˵����ȷ���ǣ������� 
A.װ�â��У������е�K+����ZnSO4��Һ
B.װ�âڹ���һ��ʱ���a��������Һ��pH����
C.��װ�â۾���ͭʱ��c��Ϊ��ͭ
D.װ�â��е�����Zn����Fe��װ������Fe2+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼ѭ������������ĸ߶����ӣ���֪ú������ȿ�����ˮ������Ӧ������CO��H2Ϊ���ĺϳ������ϳ����й㷺Ӧ�ã��Իش��������⣺
��1����¯������CO�������Ҫ��;֮һ���������ӦΪ�� FeO��s��+CO��g��Fe��s��+CO2��g����H��0��
��֪��1100��Cʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
���¶����ߣ�ƽ���ƶ���ﵽ��ƽ�⣬��ʱƽ�ⳣ��ֵ���������С�������䡱����
��1100��Cʱ��ø�¯�У�c��CO2��=0.025molL��1 �� c��CO��=0.1molL��1 �� ������������£��÷�Ӧ��һʱ�������У�����ҡ�����
��2��Ŀǰ��ҵ��Ҳ����CO2������ȼ�ϼ״����йط�ӦΪ��CO2��g��+3H2��g��CH3OH��g��+H2O��g������H=��49.0KJmol��1 �� ij�¶��£������Ϊ1L���ܱ������У�����1molCO2��3molH2 �� ��Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ�� 
�ٷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��=mol��Lmin����1 �� CO2��ת����Ϊ ��
���¶���������Ӧ��ƽ�ⳣ��K= ��
�ڷ�Ӧ�ﵽƽ���������ʹ ![]() ��ֵ����Ĵ�ʩ�������
��ֵ����Ĵ�ʩ�������
a�������¶� b���ٳ���H2 c���ٳ���CO2 d����H2O��g������ϵ�з��� e������He��g��
������Ч�ļ״�CH3OHȼ�ϵ�ز���PtΪ�缫���ϣ������缫�Ϸֱ�ͨ��CH3OH��O2 �� KOH��ҺΪ����ʣ���д��������ظ����ĵ缫��Ӧʽ �� ����ع���һ��ʱ������ı�״���µ�����11.2L����ù���ת�Ƶ���mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ǧ�����Ҫ�ɷ�ΪPbS����Ǧ�ɴ�86.6%���Է�Ǧ��Ϊԭ���Ʊ�Ǧ���صĵ缫����PbO2�Ĺ���������ͼ��ʾ��

��1����Ǧ���պ��ų��������Ҫ�ɷ���______���ѧʽ���������ڹ�ҵ�Ʊ�________��
��2��������н�̿��������________��
��3������Ǧ����������Ҫ��п������ͭ�����ȡ���⾫��ʱ��________��������������ӦʽΪ________�����������Ҫ�ɷ���________��
��4����������Ʊ�PbO2�����ӷ���ʽ________��
��5����֪�������£�Ksp(PbS)=8��10-28��Ka1(H2S)=1.3��10-7��Ka2(H2S)=7.1��10-15�������£���Pb(NO3)2��Һ��ͨ��H2S���壬������Ӧ�����ӷ���ʽ��________��������ݷ������÷�Ӧ�ܷ���еû�����ȫ��________��д�������������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г����в��漰��ѧ�仯���ǣ� ��
A.�����ɸ�
B.��������
C.����ĥ��
D.���Ͻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ���ǣ� ��
A. ������Na2SiO3��Һ��ϣ�SiO32-+2H+=H2SiO3��
B. Ũ����Ͷ������̹�����ȡCl2��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
C. NO2ͨ��ˮ�У�H2O+3NO2=2H++2NO3-+NO
D. �����ʯ��ˮ��ͨ�����SO2��SO2+Ca2++2OH-=CaSO3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������ˮ��Ӧ��˵������ȷ���ǣ� ��
A.��С����Ͷ�����ʯ����Һ��ˮ�У���Ӧ����Һ����
B.����Ͷ��ϡ�����У�������ˮ��Ӧ���������ᷴӦ
C.��Ͷ�뵽ˮ�л��д�����������
D.��Ͷ�뵽���з�̪��ˮ��Һ�У��ձ��е���Һ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������м������ʣ���O2��O3�� ��35Cl��37Cl ��CH3CH3 ��CH3CH2CH3
��CH3CH2CH(CH3)CH2CH3 �� CH3CH2CH(CH3)CH(CH3)CH3
��H2��D2 �� T2 ��
��CH3(CH2)2CH3 �� (CH3)2CHCH3 ��CH3CH(CH3)CH3 �� CH(CH3)3
�� ��
��
��1����Ϊͬλ�ص���_______________________________��
��2����Ϊͬ�����������___________________________��
��3����Ϊͬ���칹�����___________________________��
��4����Ϊͬϵ�����_______________________________��
��5������ͬ�����ʵ���_____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com