


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
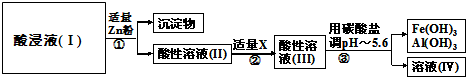
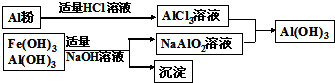

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4与C2H4 |
| B、C2H2与C3H6 |
| C、C2H4与C3H4 |
| D、CH4与C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |
| C | ↓ | ↓ | - | ↑ | - |
| B | ↓ | - | ↓ | - | - |
| A、HCl |
| B、Ca(HCO3)2 |
| C、Na2CO3 |
| D、Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铝制饮具最好不要盛放酸性或碱性较强的液体食物 | 因为Al和Al2O3既可以与酸反应,又可以与碱反应 | Ⅰ对,Ⅱ对,无 |
| B | 氯气不能使干燥的有色布条褪色,能使湿润的有色布褪色 | 说明次氯酸的氧化性比氯气强 | Ⅰ对,Ⅱ对,无 |
| C | 二氧化硫能使KMnO4溶液褪色 | 二氧化硫具有漂白性 | Ⅰ对,Ⅱ对,无 |
| D | 常温下,铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 因为铁和铝与浓硫酸或浓硝酸发生钝化. | Ⅰ对,Ⅱ对,有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 有关性质及结构信息 |
| E | E元素的基态原子具有2个成单电子,且I1(E)<I1(T)<T1(Q) |
| Q | 基态Q原子的2p轨道处于半充满状态 |
| T | T的单质和某种含T的化合物对生命活动具有重要意义 |
| X | X为元素周期表前四周期中电负性最小的元素 |
| Z | Z的一种核素的质量数为59,中子数为31 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com