
| 元素编号 | 有关性质及结构信息 |
| E | E元素的基态原子具有2个成单电子,且I1(E)<I1(T)<T1(Q) |
| Q | 基态Q原子的2p轨道处于半充满状态 |
| T | T的单质和某种含T的化合物对生命活动具有重要意义 |
| X | X为元素周期表前四周期中电负性最小的元素 |
| Z | Z的一种核素的质量数为59,中子数为31 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
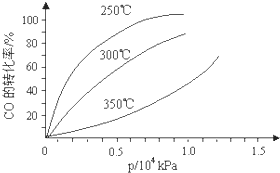 CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H
CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴离子具有氧化性 |
| B、氯气是还原剂 |
| C、该反应属于复分解反应 |
| D、氯气的氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
| B、冰醋酸、纯碱、水玻璃分别属于酸、碱、盐 |
| C、接触法制硫酸中,为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ |
| D、某物质只含有一种元素,则该物质可能为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏产品不能使溴的四氯化碳溶液褪色 |
| B、裂解是为了获得气态烯烃等有机工业原料 |
| C、煤中含有苯及其同系物 |
| D、催化重整是获得芳香烃的主要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:D>C>B>A |
| B、工业制BA3需要高温、常压、催化剂 |
| C、A与D可形成化合物AD,1mol该物质可与水反应失去1mol电子 |
| D、由A、C、D形成的化合物一定有离子键和共价键,由A、B、C形成的化合物共价键一定有,离子键不一定有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、OH-、NO3- |
| B、Na+、Fe3+、NO3-、Cl- |
| C、NH4+、H+、HCO3-、SO42- |
| D、Ag+、Ca2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com