
下列事实中,不能用勒夏特列原理解释的是:
| A.密闭、低温是存放氨水的必要条件 |
| B.实验室常用排饱和食盐水法收集氯气 |
| C.硝酸工业生产中,使用过量空气以提高NH3的利用率 |
| D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量 |
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:单选题
向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:
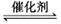
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态 |
| D.当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将H2和Br2充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g) 2HBr(g) △H<0;平衡时Br2的转化率为a,若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b,则a与b的关系是( )。
2HBr(g) △H<0;平衡时Br2的转化率为a,若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b,则a与b的关系是( )。
| A.a>b | B.a=b | C.a < b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列条件:①增加反应物的物质的量;②升高温度;③缩小反应容器的体积;④不断分离出生成物;⑤加入MnO2,一定能使反应速率增大的是
| A.② | B.②③ | C.①②⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: >
> ,且体系中
,且体系中 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气) NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
| A.3.5mol/L | B.4.5mol/L | C.4mol/L | D.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碘单质难溶于小却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.增大体系压强,活化分子数增加,化学反应速率一定增大 |
| B.加入反应物,使活化分子百分数增加,化学反应速率增大 |
| C.活化分子间所发生的分子间的碰撞均为有效碰撞 |
| D.升高温度,活化分子百分数增加,化学反应速率一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g) xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
A.x=1
B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D.甲和乙的平衡转化率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com