
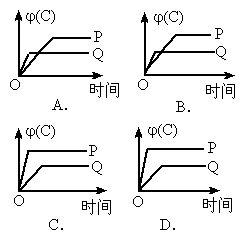
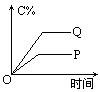
在A(g)+B(g) C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线有Q与P,则正反应是放热反应的图为
C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线有Q与P,则正反应是放热反应的图为
[ ]
|
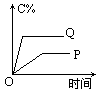
解答本题的关键,就是根据图示正确判断 Q、P曲线到底分别表示什么温度的变化.其判断方法是:温度越高,反应速率就越快,则可逆反应达到平衡的时间就越短,变化曲线的斜率就越大,反之,反应温度越低,反应速率就越慢,达到平衡时间就越长,变化曲线的斜率就越小.因此对于A图,Q曲线表示400℃,P曲线表示100℃,从中可看出在其他条件不变时由于温度不同分别达到平衡后100℃时j (C)较大,而400℃时j (C)较小,说明升高温度,平衡是向逆反应方向移动的.则逆反应是吸热反应,正反应为放热反应,A选项符合题意.对于 B图,Q曲线表示100℃,P曲线表示400℃,温度高时,j (C)小,则正反应为放热反应;对于C图,Q曲线表示100℃,P曲线表示400℃,温度低时,j (C)小,则正反应为吸热反应;对于D图,Q曲线表示400℃,P曲线表示100℃,温度高时,j (C)大,则正反应为吸热反应. |


科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:013
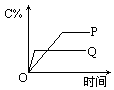
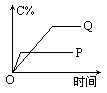
在A(g)+B(g)![]() C(g)+D(g)的反应体系中,C的百分含量和时间的关系如下图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,正反应是吸热反应的图为
C(g)+D(g)的反应体系中,C的百分含量和时间的关系如下图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,正反应是吸热反应的图为
[ ]
查看答案和解析>>
科目:高中化学 来源:辽宁省沈阳二中2011-2012学年高一上学期12月月考化学试题 题型:038
在天平左右两盘上各放一只同等规格的烧杯,烧杯内均盛有1.00 mol·L-1的稀H2SO4 100.0 mL,调节天平使其处于平衡状态,然后向两只烧杯内分别放入少量的铝粉和镁粉(设铝、镁的质量分别为a g和b g),假定反应后天平仍处于平衡状态.
请回答下列问题:
(1)a、b应满足的关系式为(要求写解题过程).
(2)a、b的取值范围为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g) 2CO2(g); △H=-566kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(1); △H=-890kJ·mol-1
又知由H2与O2反应生成液态H2O 比生成气态H2O 多放出44kJ/mol的热量。则CH4 气体在空气中不完全燃烧热化学方程式正确的是
A.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(1) △H=-1214kJ·mol-1
B.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(g) △H=-1038kJ·mol-1
C.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(1) △H=-1538kJ·mol-1
D.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(g) △H=-1840kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:浙江省期中题 题型:填空题
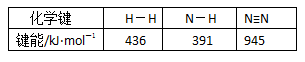
 2NH3(g) ;△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________(注明“+“-”)。
2NH3(g) ;△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________(注明“+“-”)。 CH3OH(g);△H =-90.8 kJ·mol-1
CH3OH(g);△H =-90.8 kJ·mol-1  CH3OCH3(g) + H2O(g);△H=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);△H=-23.5 kJ·mol-1  CO2(g) + H2(g);△H=-41.3 kJ·mol-1
CO2(g) + H2(g);△H=-41.3 kJ·mol-1  CH3OCH3(g) + CO2 (g)的△H=____________。
CH3OCH3(g) + CO2 (g)的△H=____________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com