
����Ŀ����֪A��һ����̬��������µ��ܶ�Ϊ1��25g/L������AΪ��Ҫԭ���ϳ�һ�־��й���ζ������E����ϳ�·������ͼ��ʾ��

��1��д��A�Ľṹ��ʽ ��
��2��B��D���������������ŵ����Ʒֱ��� �� ��
��3������B����ֱ������ΪD����Ҫ������Լ��� ��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ�ڵĻ�ѧ����ʽ�� ����Ӧ���ͣ� ��
��Ӧ�ܵĻ�ѧ����ʽ�� ����Ӧ���ͣ� ��
��5��B���ɺ����۵�Ũ��Ʒ�����ס�С������Ⱦ����͡�������á���д������ˮ��Ļ�ѧ����ʽ
���𰸡���1��CH2=CH2
��2���ǻ� �Ȼ�
��3������KMnO4��Һ������K2CrO7��Һ���𰸺���������
��4��2CH3CH2OH��O2![]() 2CH3CHO��2H2O
2CH3CHO��2H2O
����������������CH3COOH��CH3CH2OH![]() CH3COOC2H5��H2O
CH3COOC2H5��H2O
������Ӧ����ȡ����Ӧ��
��5��![]()
��������
���������A��һ����̬��������µ��ܶ�Ϊ1��25g/L����A��Է���������M=1��25g/L��22��4L/mol=28������A����ϩ���ṹ��ʽ��CH2=CH2,��ϩ��ˮ�����ӳɷ�Ӧ������B���Ҵ����Ҵ�������������C����ȩ����ȩ������������D������Ҵ������ᷢ��������Ӧ������E������������
��1����ϩ�Ľṹ��ʽ��CH2=CH2��
��2��B���Ҵ������������ǻ���D�����ᣬ�������������������Ȼ���
��3������B����ֱ������ΪD����Ҫǿ�����������ʣ���Ҫ������Լ�������KMnO4��Һ������K2CrO7��Һ�ȣ�
��4����Ӧ�ڵĻ�ѧ����ʽ��2CH3CH2OH��O2![]() 2CH3CHO��2H2O����Ӧ������������Ӧ����Ӧ�ܵĻ�ѧ����ʽ��CH3COOH��CH3CH2OH
2CH3CHO��2H2O����Ӧ������������Ӧ����Ӧ�ܵĻ�ѧ����ʽ��CH3COOH��CH3CH2OH![]() CH3COOC2H5��H2O����Ӧ���ͣ�������Ӧ ����ȡ����Ӧ����
CH3COOC2H5��H2O����Ӧ���ͣ�������Ӧ ����ȡ����Ӧ����
��5���Ҵ����ɺ����۵�ũ��Ʒ�����ס�С�������ˮ����������ǣ����������������Ҵ�������ˮ��Ļ�ѧ����ʽ��![]() ��
��


 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳƷ�㾫������������·�ߣ���Ӧ������ȥ�����£�

��������������ǣ� ��
A�����裨1�������в����ı��ӿ���FeCl3��Һ����
B�����ӺͲ���������������KMnO4��Һ������Ӧ
C����������Ͳ�����������NaOH��Һ������Ӧ
D�����裨2�������в����ı�ϩ��������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2L���ܱ�������ͨ���������巢����ѧ��Ӧ����Ӧ�и����ʵ����ʵ����仯��ͼ��ʾ��6sʱ��Ӧ�Ѵﵽƽ��״̬�����Ը÷�Ӧ���ƶ���ȷ���ǣ� ��

A���÷�Ӧ�Ļ�ѧ����ʽΪ3B+4D6A+2C
B����Ӧ���е�1sʱ��v��A��=v��C��
C����Ӧ���е�6sʱ��B��D�����ʵ���Ũ�Ⱦ�Ϊ0.4molL��1
D����Ӧ���е�6sʱ��B��ƽ����Ӧ����Ϊ0.05mol/��Ls��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���һ��ȼ�ϵ�أ�����ͼ��ʾ����Ŀ����̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��

����Ҫ��ش�������⣺
��1��ͨ�������ĵ缫Ϊ ������������������������ĵ缫��ӦʽΪ ��
��2��ʯī�缫Ϊ �����������������������Ӧһ��ʱ�������װ���е����̪��Һ �������������ʯī����������Һ�ȱ�졣
��3�������ͭ�к���п���������ʣ���װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ� ��������� С�����䡱������ͭ�缫�ϵĵ缫��ӦʽΪ ��
��4��������װ�����Ȼ�����Һ�㹻�࣬���ڱ�״���£���224mL�����μӷ�Ӧ������װ���������ӽ���Ĥ�����Һ������ ����������� С�����䡱�����ұ仯�� �ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���й۲쵽������ָ��ƫת��M����֣�N����ϸ��ָ��ָ��M���ɴ��ж��±�������M��N��P���ʣ����п��Գ���������ǣ� ��
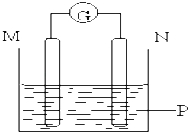
M | N | P | |
A | п | ͭ | ϡ������Һ |
B | ͭ | �� | ϡ������Һ |
C | �� | п | ��������Һ |
D | п | �� | ��������Һ |
A��A B��B C��C D��D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij����С��ͬѧ��ͼ1װ�ý���ʵ�飬�Իش��������⣺
������ʼʱ����K��a���ӣ����������绯ѧ��ʴ�е� ��ʴ��
������ʼʱ����K��b���ӣ����ܷ�Ӧ�����ӷ���ʽΪ ��
��2��â����ѧʽΪNa2SO410H2O����ɫ���壬������ˮ����һ�ֲַ��ܹ㷺�������ο����С��ͬѧ���룬���ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������ͼ2��ʾװ�õ����������Һ����ȡ������������������������ƣ����۴ӽ�ʡ��Դ���Ǵ����ԭ�ϵ������ʶ��Զ����ӷ�����ɫ��ѧ���
�ٸõ��۵�������ӦʽΪ ����ʱͨ�������ӽ���Ĥ�������� ������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
���Ƶõ�����������Һ�ӳ��ڣ��A������B������C����D���� ������
��ͨ�翪ʼ������������ҺpH�����������ԭ��
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ ����֪H2��ȼ����Ϊ285.8kJmol��1�����ȼ�ϵ�ع�������36g H2Oʱ���������� kJ������ת��Ϊ���ܣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���3.0molM��2.5molN�����2.0L���ܱ������У�������Ӧ�Ļ�ѧ����ʽΪ��3M(g)+N(g)![]() xP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.10 molL��1min��1������˵��������ǣ� ��
xP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.10 molL��1min��1������˵��������ǣ� ��
A��x��ֵΪ1 B��M��ƽ����Ӧ����Ϊ0.15 molL��1min��1
C��M��ת����Ϊ60% D��ƽ��ʱp��Ũ��Ϊ0.25 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ�䣬���ʵ�����Σ����������ȫ�����Ŀ���佹��������dz��ʺ˵�վ������ˮ�ѻ�����ˮ�ѣ���ˮ�Ѻ˵�վ�ڷ����ͬʱ�������������ɹ����ƺ��������У�![]() Pu���������й�
Pu���������й�![]() PuPu��˵������ȷ���ǣ� ��
PuPu��˵������ȷ���ǣ� ��
A. ![]() Pu��94������
Pu��94������
B. ![]() Pu�е���������������֮��Ϊ51
Pu�е���������������֮��Ϊ51
C. ![]() Pu���94������
Pu���94������
D. ![]() Pu�������
Pu�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ���ǣ� ��
A��![]() 2���һ�����
2���һ�����
B��![]() ����ױ�
����ױ�
C��CH3CH2CH2CH2OH 1������
D��![]() 2������2����ϩ
2������2����ϩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com