
【题目】在密闭容器中进行X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
A.c(X2)=0.15mol·L-1B.c(Y2)=0.9mol·L-1
C.c(Z2)=0.3mol·L-1D.c(Q2)=0.5 mol·L-1
【答案】B
【解析】
化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值。
A项、X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应X2浓度增大,说明反应逆向进行建立平衡,所以0.1 mol·L-1<c(X2)<0.2 mol·L-1,c(X2)=0.15mol·L-1可能,故A错误;
2Z2(g)+3Q2(g)的反应X2浓度增大,说明反应逆向进行建立平衡,所以0.1 mol·L-1<c(X2)<0.2 mol·L-1,c(X2)=0.15mol·L-1可能,故A错误;
B项、X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应Y2浓度增大,说明反应逆向进行建立平衡,得到0.4 mol·L-1<c(Y2)<0.8 mol·L-1,c(Y2)=0.9mol·L-1不可能,故B正确;
2Z2(g)+3Q2(g)的反应Y2浓度增大,说明反应逆向进行建立平衡,得到0.4 mol·L-1<c(Y2)<0.8 mol·L-1,c(Y2)=0.9mol·L-1不可能,故B正确;
C项、X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应Z2浓度增大,说明反应正向进行建立平衡,得到0.2 mol·L-1<c(Z2)<0.4 mol·L-1,c(Z2)=0.3mol·L-1可能,故C错误;
2Z2(g)+3Q2(g)的反应Z2浓度增大,说明反应正向进行建立平衡,得到0.2 mol·L-1<c(Z2)<0.4 mol·L-1,c(Z2)=0.3mol·L-1可能,故C错误;
D项、X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应Q2浓度增大,说明反应正向进行建立平衡,得到0.3 mol·L-1<c(Q2)<0.6 mol·L-1,c(Q2)=0.5 mol·L-1可能,故D错误;
2Z2(g)+3Q2(g)的反应Q2浓度增大,说明反应正向进行建立平衡,得到0.3 mol·L-1<c(Q2)<0.6 mol·L-1,c(Q2)=0.5 mol·L-1可能,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】(1)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____(填“放热”或“吸热”)反应。
②乙容器在50min时达到平衡状态,则NO的浓度是______,0~50min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)_______Kc(C)(填“<”、“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”、“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为
A.-Y kJ/molB.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/molD.+(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
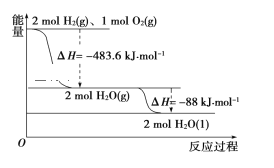
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(![]() )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为![]() )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①![]()
![]()
②![]()
![]()
③![]()
![]()
则![]() 的
的![]() ________(用含
________(用含![]() 、
、![]() 、
、![]() 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①下列说法正确的是________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加![]() 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时![]() 的浓度为1.4 mol·L1,充入一定量的
的浓度为1.4 mol·L1,充入一定量的![]() ,反应再次达到平衡,
,反应再次达到平衡,![]() 浓度________(填“
浓度________(填“![]() ”“
”“![]() ”或“
”或“![]() ”) 1.4 mol·L1。
”) 1.4 mol·L1。
⑶在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,若仅发生反应:
,若仅发生反应: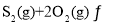
![]() ,
,![]() 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则![]() 内,
内,![]() 的反应速率为________
的反应速率为________![]() 。
。
⑷在恒容密闭容器中,加入足量的![]() 和
和![]() ,仅发生反应:
,仅发生反应:![]()
![]()
![]() 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
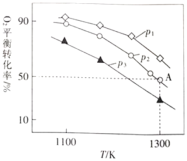
①![]() ________(填“
________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)0;比较
”)0;比较![]() 、
、![]() 、
、![]() 的大小:________。
的大小:________。
②若初始时通入![]() ,
,![]() 为
为![]() ,则
,则![]() 点平衡常数
点平衡常数![]() ________(用气体平衡分压代替气体平衡浓度计算,分压
________(用气体平衡分压代替气体平衡浓度计算,分压![]() 总压
总压![]() 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)可用于冶金、电镀等行业,其制备的一种工艺流程如下:
I.溶解:取海绵铜(主要含Cu和CuO),加入稀硫酸和NH4NO3的混合溶液,控制溶液温度在60~70℃,不断搅拌至固体全部溶解,得蓝色溶液(过程中无气体产生);
II.转化:向蓝色溶液中加入(NH4)2SO3和NH4Cl,充分反应后过滤,得到CuCl粗品;
III.洗涤:CuCl粗品依次用pH=2硫酸和乙醇洗涤,烘干后得到CuCl产品。
(资料)CuCl固体难溶于水,与Cl-反应生成可溶于水的络离子[CuCl2]-;潮湿的CuCl固体露置于空气容易被氧化。
(1)过程I中:
①本工艺中促进海绵铜溶解的措施有________。
②氧化铜溶解的离子方程式是________。
③充分反应后NH4+的浓度约为反应前的2倍,原因是________。
(2)过程II中:
①(NH4)2SO3的作用是_________。
②NH4Cl的用量对铜的沉淀率的影响如下图所示。
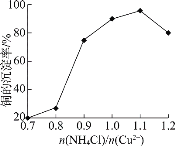
n(NH4Cl)/n(Cu2+)![]() 1.1时,CuCl的沉淀率下降的原因是________(用离子方程式表示)。
1.1时,CuCl的沉淀率下降的原因是________(用离子方程式表示)。
(3)过程III中,用乙醇洗涤的目的是________。
(4)产品纯度测定:量取CuCl产品a g于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000 mol/L KMnO4标准溶液滴定Fe2+,消耗KMnO4溶液b mL。(本实验中的MnO4-被还原为Mn2+,不与产品中杂质和Cl-反应)。
①CuCl溶于Fe2(SO4)3溶液的离子方程式是_________。
②产品中CuCl(摩尔质量为99g/mol)的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种氨化剂,易水解,难溶于CCl4。某小组设计下图所示装置制备氨基甲酸铵。已知:2NH3(g) + CO2(g)![]() H2NCOONH4(s) H<0。
H2NCOONH4(s) H<0。
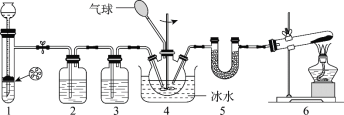
下列分析不正确的是
A.2中的试剂为饱和NaHCO3溶液
B.冰水浴能提高H2NCOONH4的产率
C.1和4中发生的反应均为非氧化还原反应
D.5中的仪器(含试剂)可用3中仪器(含试剂)代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.用FeCl3溶液制作铜质印刷线路板:2Fe3++ Cu = Cu2++ 2Fe2+
B.Al片溶于NaOH溶液中产生气体:2Al + 2OH-=2![]() + H2↑
+ H2↑
C.用难溶的MnS除去MnCl2溶液中含有的Pb2+:MnS(s) + Pb2+(aq) =PbS (s) + Mn2+(aq)
D.向银氨溶液中滴加乙醛后水浴加热,出现银镜:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com