
| A. | 在通常状况下,新制的氯水呈黄绿色 | |
| B. | 将足量氯水加入到紫色石蕊试液中,溶液只能变成红色 | |
| C. | 将氯水加入到NaHCO3粉末中,有气泡产生 | |
| D. | 将氯水加入到硝酸酸化的AgNO3溶液中,有白色沉淀产生 |
分析 氯气微溶于水,氯水中,氯气与水发生:Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,氯水具有酸性和强氧化性,其中HClO见光易分解生成盐酸而变质,以此解答.
解答 解:A.氯气微溶于水,新制的氯水呈黄绿色,故A正确;
B.氯气溶于水,部分氯气与水反应发生反应:Cl2+H2O?HCl+HClO,盐酸具有酸性,次氯酸具有漂白性,所以新制氯水滴在紫色石蕊试纸上,试纸先变红色后褪色,故B错误;
C.新制氯水中存在盐酸,新制氯水滴到Na2CO3溶液中,发生NaHCO3+HCl═NaCl+H2O+CO2↑,有气体产生,故C正确;
D.氯气与水反应生成盐酸,加入硝酸银生成氯化银沉淀,故D正确.
故选B.
点评 本题考查氯气的性质,为元素化合物知识的高频考点,有利于培养学生的良好的科学素养和学习的积极性,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
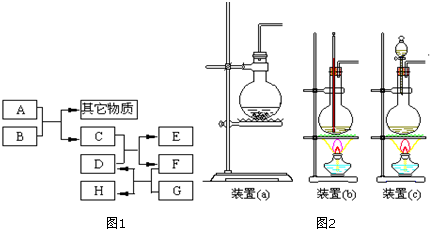
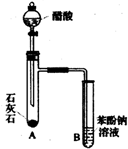 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.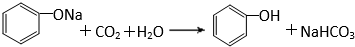 .
. 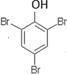 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+CO2 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Ca(ClO)2+2HCl═CaCl2+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: | B. | CH2F2的电子式: | ||
| C. | 对硝基甲苯的结构简式: | D. | 异丙醇的结构简式:CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

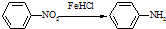 (苯胺,易被氧化)
(苯胺,易被氧化)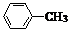 .
.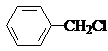 .
.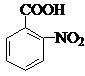 .反应②③两步能否互换不能,(填“能”或“不能”)理
.反应②③两步能否互换不能,(填“能”或“不能”)理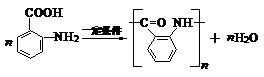 ;反应⑤的化学方程式是
;反应⑤的化学方程式是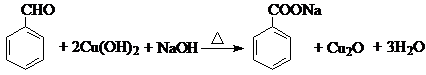 .
.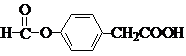 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2比Na20化学性质稳定 | |
| B. | 均与水反应生成NaOH,因而均是碱性氧化物 | |
| C. | Na20能被氧化成Na2O2 | |
| D. | 均可与H2O、CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com