
| | A | B | C | D |
| SO3 | 1 mol | 3 mol | 3 mol | 0 mol |
| SO2 | 2 mol | 1.5 mol | 0 mol | 6 mol |
| O2 | 2 mol | 1 mol | 0 mol | 5 mol |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��3.6��H | B��1.8��H |
| C��2��H | D��0.9��H |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
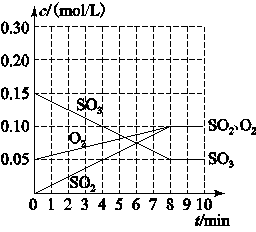
 2SO3(g)��H����Q1 KJ/mol�����ܱ�������ͨ��2mol SO2��1mol O2���ﵽƽ��ʱ�ų�����Q2KJ�����ϵʽ��ȷ����
2SO3(g)��H����Q1 KJ/mol�����ܱ�������ͨ��2mol SO2��1mol O2���ﵽƽ��ʱ�ų�����Q2KJ�����ϵʽ��ȷ����| A��Q1��Q2 | B��Q1��Q2 | C��Q1��Q2 | D�����Ƚ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 b Z��g����Ӧ�ﵽƽ����X��ת����Ϊ50%�����ң���ͬ��ͬѹ�»���÷�Ӧǰ���������ܶ��Ƿ�Ӧ���������ܶȵ�
b Z��g����Ӧ�ﵽƽ����X��ת����Ϊ50%�����ң���ͬ��ͬѹ�»���÷�Ӧǰ���������ܶ��Ƿ�Ӧ���������ܶȵ� ����a��b����ֵ������
����a��b����ֵ������| A��a =1��b =1 | B��a =2��b =1 |
| C��a =2��b =2 | D��a =3��b =2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g)+H2(g)��CO(g)+H2O(g)
CO(g)+H2(g)��CO(g)+H2O(g) CO2(g)+H2(g) ����Ӧ��ƽ��ʱ�����c(H2)=1.9 kJ��mol-1��c(CO)="0.1" kJ��mol-1����CO2��Ũ��Ϊ
CO2(g)+H2(g) ����Ӧ��ƽ��ʱ�����c(H2)=1.9 kJ��mol-1��c(CO)="0.1" kJ��mol-1����CO2��Ũ��Ϊ| A��0.1 kJ��mol-1 | B��0.9 kJ��mol-1 | C��1.8 kJ��mol-1 | D��1.9 kJ��mol-1[ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2CrO42-�� 2H+��ƽ�⣬����Cr2O72-�ʳ�ɫ��CrO42-�ʻ�ɫ�����ƽ����ϵ�еμӱ���NaOH��Һʱ����ɫ�ı仯�����
2CrO42-�� 2H+��ƽ�⣬����Cr2O72-�ʳ�ɫ��CrO42-�ʻ�ɫ�����ƽ����ϵ�еμӱ���NaOH��Һʱ����ɫ�ı仯�����| A����ɫ���� | B����ɫ���� | C����ɫ���� | D����ɫ��ȥ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������8 mol | B������1.6 mol | C������0.8 mol��1.6 mol? | D������1.6 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
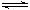 2SO3(g) ��H=��197kJ/mol����25��ʱ�����ѹ�ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����a1����25��ʱ�ڴ˺�ѹ�ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����a2�������й�ϵ��ȷ����
2SO3(g) ��H=��197kJ/mol����25��ʱ�����ѹ�ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����a1����25��ʱ�ڴ˺�ѹ�ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����a2�������й�ϵ��ȷ����| A��2a2=a1="197" kJ | B��197 kJ> a1=2a2 |
| C��a2>a1>197 kJ | D��2a2<a1<197 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��SO2(g)+NO2(g) 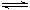 SO3(g)+NO(g)��H��0 SO3(g)+NO(g)��H��0 |
B��C(s)+CO2(g) 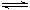 2CO(g)��H��0 2CO(g)��H��0 |
C��4NH3(g)+5O2(g) 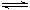 4NO(g)+6H2O(g)��H��0 4NO(g)+6H2O(g)��H��0 |
D��H2S(g) 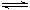 H2(g)+S(s)��H��0 H2(g)+S(s)��H��0 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com