
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
C(s)+O2(g) =CO2(g);△H=" -393.5" kJ/mol
2C(s)+O2(g)=2CO(g);△H= -221kJ/mol
则2NO(g)+2CO(g) N2(g) +2CO2(g)的△H=___________。
N2(g) +2CO2(g)的△H=___________。
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,且N2占平衡总体积的1/4。
①则该反应的平衡常数K=_______ ____。(用只含a、V的式子表示)
②判断该反应达到平衡的标志是____ _____
A.v生成(CO2)=v消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是___________
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
①写出此变化中的总化学反应方程式:________________________________________。
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。请你判断是否可行并说出理由:_____________________________________________________________。
(14分) (1) △H="-746.5" kJ/mol(2分) (2)①K=27V/a (2分) ②CD(2分) ③(2分)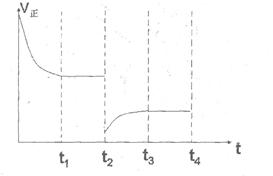
(3)B(2分) (4)2NO+O2+4CO 4CO2+N2(2分、)
4CO2+N2(2分、)
②不可行,因为△H>0,△S<0,在任何情况下都不能自发进行。(2分)
解析试题分析:(1)根据盖斯定律可知,②×2-①-③即得到2NO(g)+2CO(g) N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。
N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。
(2)①达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,则CO2的物质的量应该是2bmol。又因为N2占平衡总体积的1/4,则b=3a。由于化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应式可知,K=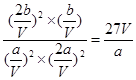 。
。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以D正确。A中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此A中的关系始终是成立,不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以C可以说明,答案选CD。
③在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图像应该是(见答案)。
(3)该反应是体积减小的、放热的可逆反应,所以要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是选项B,A中反应速率降低,C中转化率降低,D中反应速率降低,答案选B。
(4)①根据图示可知,最终的生成物是CO2和氮气,所以总的方程式是2NO+O2+4CO 4CO2+N2。
4CO2+N2。
②因为根据反应式可知,该反应的△H>0,△S<0,在任何情况下都不能自发进行,所以是不可取的。
考点:考查反应热的计算、平衡常数的计算、平衡状态、反应自发性的判断以及外界条件对反应速率和平衡状态的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ?mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是( )
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ?mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
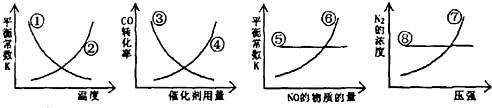
| A、①⑥⑧ | B、①⑤⑦ | C、②③④ | D、③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三上学期期末考试化学试卷(解析版) 题型:选择题
汽车尾气净化中的一个反应如下:

在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
A.达到平衡后,若只升高温度,化学平衡正向移动
B.达到平衡后,再通人稀有气体,逆反应速率增大
C.使用催化剂,平衡常数不变
D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com