
【题目】现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: 
(1)操作①是利用胶体不能通过而把淀粉胶体和溶液进行分离.
(2)写出上述实验过程中所用试剂的化学式:试剂①;试剂③ .
(3)判断试剂①已过量的操作是: .
(4)控制试剂③适量的方法是: .
(5)试剂②的作用(用化学方程式表示): .
【答案】
(1)半透膜
(2)BaCl2;HCl
(3)静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量
(4)当溶液中不产生气泡时,就可以停止加盐酸
(5)Ba2++CO32﹣=BaCO3↓
【解析】解:(1)淀粉为胶体,粒子直径较大,不能透过半透膜,所以可以把淀粉胶体和溶液进行分离,故答案为:半透膜;(2)由以上分析可知试剂①为BaCl2 , 试剂③为HCl,故答案为:BaCl2;HCl;(3)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量,
故答案为:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;(4)试剂③为盐酸,加入盐酸可除去过量的Na2CO3 , 同时产生气泡,所以控制试剂③适量的方法是观察溶液中是否有气泡出现,当溶液中不产生气泡时,就可以停止加盐酸,故答案为:当溶液中不产生气泡时,就可以停止加盐酸;(5)试剂②为Na2CO3 , 是用来除去溶液中的钡离子的,反应的离子方程式为Ba2++CO32﹣=BaCO3↓,
故答案为:Ba2++CO32﹣=BaCO3↓.
胶体不能透过半透膜,操作①为渗析,除去Na2SO4、CaCl2 , 可分别加入BaCl2、Na2CO3 , 除去粗盐中含有的Ca2+、SO42﹣可溶性杂质的方法:加入过量BaCl2 , 去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2 , 操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3 , 操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3 , 最后蒸发结晶可得到NaCl晶体,以此解答该题.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】2013年9月以来,我国很多地区再大面积出现雾霾,特别是华中华北尤其严重,汽车尾气、燃煤废气和冬季取暖排放的CO2等都是形成雾霾的原因。
Ⅰ.用于净化汽车尾气的反应为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
(1)能判断该反应达到平衡状态的标志是_______。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
(2)在t2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:___________

Ⅱ.使用石油热裂解的副产物CH4来制取H2,其生产流程如图1所示:
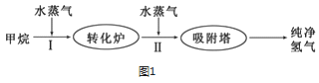
(3)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)
CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)

(4)此流程的第Ⅱ步反应的平衡常数随温度的变化情况如下表
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从表上可以推断该反应是___________(填“吸热”或“放热”)反应,若反应在500℃时进行,设CO(g)和H2O(g)的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为________;
(5)图3表反应Ⅱ在t1时达到平衡,在t2时因改变某个条件引起浓度变化的情况,图中t2时改变的条件是降低温度或________________(写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理相同
B. 交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应
C. 乙酸的分子式为C2H4O2,属于弱酸
D. 苯分子中没有碳碳双键,因此苯不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则消耗的氯气的总的物质的量是
A. 3mol B. 4mol C. 5mol D. 6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是

A. a电极是该电池的负极
B. b电极上发生的反应为:O2+4H++4e-=2H2O
C. H+由a电极向b电极迁移
D. 电池工作时,电子从a电极→灯泡→b电极→电解液→a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
【查阅资料】
Ⅰ.金属Ca的部分性质有:
①常温或加热条件下Ca都能与氧气反应;
②Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③Ca+H2 ![]() CaH2(固体)
CaH2(固体)
Ⅱ.固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑; ②CaH2要密封保存.
(1)【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).
回答下列问题:
(i)写出Ca常温遇水发生反应的化学方程式: .
(ii)B、D中所盛试剂相同,该试剂为(填名称);D中该试剂的作用是 .
(iii)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: .
(2)【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2样品,按图所示连接仪器(固定装置略).
步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL.
(iv)若该实验条件下的气体摩尔体积为Vm L/mol,当V=mL时(用m、Vm表示),表明制得的CaH2样品是纯净的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计的步骤及现象均正确的是( )
选项 | 实验目的 | 实验步骤及现象 |
A | 证明氯水有酸性 | 试样 |
B | 检验某红棕色气体是否为溴蒸气 | 试样 |
C | 证明酸性条件下H2O2氧化性比 I2强 | NaI |
D | 比较: Ksp(AgCl)>Ksp(AgI) | AgNO3 溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时纯水的电离度α1,pH=11的氨水中水的电离度为α2,pH=3的盐酸中水的电离度α3.若将上述氨水与盐酸等体积混合,所得溶液中的电离度为α4下列关系式中正确的是
A.α1<α2<α3<α4B.α3=α2<α1<α4
C.α2<α3<α1<α4D.α2=α3<α4<α1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com