
【题目】阅读表短周期主族元素的相关信息:
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是其内层电子数的三倍 |
C | 在第3周期元素中,C的简单离子半径简单最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
请回答:
(1)写出E在元素周期表中的位置:;C的简单离子的结构示意图: .
(2)X的化学式为 .
(3)A,B,C三种元素的简单离子的半径由大到小的顺序为(用离子符号表示).
(4)A,B两元素组成的化合物A2B2属于(填“离子”或“共价”化合物).
(5)C元素形成的单质能与A的最高价氧化物对应的水化物反应,其离子方程式为 .
【答案】
(1)第二周期第ⅣA族;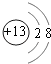
(2)NaClO
(3)O2﹣>Na+>Al3+
(4)离子化合物
(5)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
【解析】解:(1)E为碳元素,原子有2个电子层,最外层电子数为4,原子结构示意图为 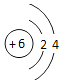 ,处于周期表中第二周期第ⅣA族;C为铝元素,铝离子核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为
,处于周期表中第二周期第ⅣA族;C为铝元素,铝离子核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为 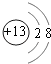 , 所以答案是:第二周期第ⅣA族;
, 所以答案是:第二周期第ⅣA族; 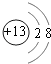 ;(2)短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;A,B,D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,所以答案是:NaClO;(3)A、B、C三种元素形成的简单离子分别为Na+、O2﹣、Al3+ , 离子的电子层排布相同,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为O2﹣>Na+>Al3+ , 所以答案是:O2﹣>Na+>Al3+;(4)A、B形成的一种A2B2化合物的化学式为Na2O2 , 由钠离子和过氧根离子构成,存在的化学键有离子键、共价键,属于离子化合物,所以答案是:离子化合物;(5)C为铝元素,A为钠元素,C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑.
;(2)短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;A,B,D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,所以答案是:NaClO;(3)A、B、C三种元素形成的简单离子分别为Na+、O2﹣、Al3+ , 离子的电子层排布相同,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为O2﹣>Na+>Al3+ , 所以答案是:O2﹣>Na+>Al3+;(4)A、B形成的一种A2B2化合物的化学式为Na2O2 , 由钠离子和过氧根离子构成,存在的化学键有离子键、共价键,属于离子化合物,所以答案是:离子化合物;(5)C为铝元素,A为钠元素,C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑.


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】有关材料用途的说法中不正确的是( )。
A.氧化铝陶瓷可用作高压钠灯的灯管
B.氮化硅陶瓷可用作陶瓷发动机的材料
C.光导纤维可用作遥测遥控、照明等
D.氧化铝陶瓷可用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 是一种大气污染物,工业上采取多种方法减少它的排放。
(1)工业上可采取生物脱H2S 方法减少H2S 的排放。生物脱H2S 的原理为:H2S + Fe2(SO4)3= S↓+ 2FeSO4 + H2SO4 4FeSO4 +O2 +2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
试回答下列问题:
①硫杆菌存在时,FeSO4被氧化的速率是无菌时5.0×105倍,该菌的作用是_________。
②由下图1和图2 判断使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是____________。
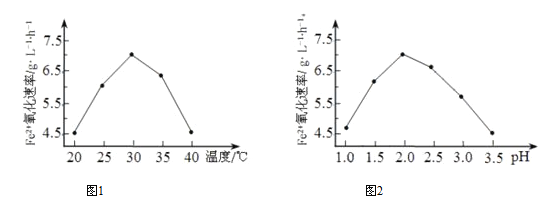
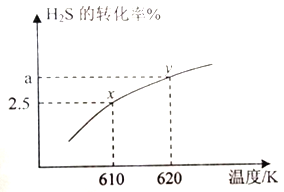
(2) 羰基硫(COS) 常在石化工业中用作在线仪表的校正气、标准气。其制备方法之一是H2S 与COS 在高温下发生反应: H2S(g)+CO2(g)![]() COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
①下列说法能表明反应已达平衡状态的是__________。
A.H2S 和CO2的物质的量之比保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量不再变化D.v逆(H2S)=V正(COS)
②该反应的△H______0.(填“>”“<”或“=”);x点对应温度下反应的平衡常数K=_____(保留两位有效数字)。
③在620K重复试验,若平衡后水的物质的量分数为0.030.则H2S 的转化率a=_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为﹣80℃,沸点137.1℃.在空气中强烈发烟,易与水发生反应.人们使用它作橡胶硫化剂使橡胶硫化,改变生橡胶受热发粘遇冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2 . 下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). 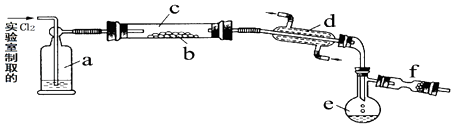
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 .
(2)装置a中应放试剂为 , 其作用为 .
(3)该实验的操作顺序应为:②﹣(用序号表示). ①加热装置c ②通入Cl2③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)f装置中应放置的试剂为 , 其作用为 .
(5)已知S2Cl2与H2O反应时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化不属于煤或石油的综合利用的是( )
A.将煤干馏制得煤焦油和焦炭
B.在一定条件下将煤与氢气转化为液体燃料
C.将煤变为煤饼作燃料
D.将石油裂解制得乙烯等化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: SO2(g) +1/2O2(g) ![]() SO3(g) △H=-98 kJ·mol- 1。
SO3(g) △H=-98 kJ·mol- 1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时 v(正)_____v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为____________ 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(______)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
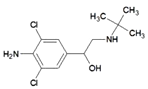
A. 瘦肉精学名盐酸克伦特罗,结构如右图,可以发生取代、加成、水解、酯化、消去反应
B. C3H7OH与C4H9OH分子间脱水,最多可生成6种醚
C. 1mol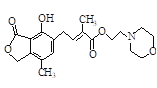 最多可与含4mol NaOH的水溶液完全反应
最多可与含4mol NaOH的水溶液完全反应
D. 某油脂的化学式为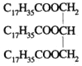 ,它既属于酯类又属于高分子化合物
,它既属于酯类又属于高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com