
【题目】下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
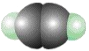

A.32 g S8分子中含有0.125 mol σ键
B.SF6是由极性键构成的非极性分子
C.1 mol C2H2分子中有3 mol σ键和2 mol π键
D.1 mol S8中含有8 mol S—S键
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是 。
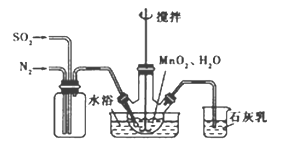
(2)实验室模拟工业二氧化锰制备硫酸锰装置如图
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
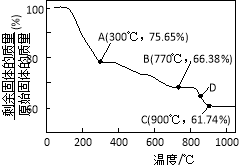
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物再生产和生活中有广泛的应用,其吸收和处理及相互转化具有广泛的意义
(1)二氧化硫具有还原性,可以和许多氧化剂反应,二氧化硫气体通入硫酸酸化的重铬酸钾溶液中,恰好生成铬钾钒[ KCr(SO4)2.12H2O],写出反应的化学方程式反应中被还原的元素
(2)过量二氧化硫通入硫化钠溶液可以看到黄色沉淀,产物还有一种盐,写出反应的离子方程式
(3)在1L0.3mol/L的氢氧化钠溶液中,通入4.48L二氧化硫(标况)反应后得到的溶液中微粒的浓度之间有一些等量关系: 任写一个
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
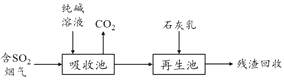
① 用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
② 若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. Na2O2可用作供氧剂
B. Al2O3可用作耐火材料
C. 地沟油经处理后可用作燃料油
D. 胶体和溶液的本质区别是胶体具有丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:
CH3COONa+NaOH![]() CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于 晶体(填晶体类型);
②MgO晶体的熔点比CaO高,主要原因是 。
(2)C60、金刚石和石墨是三种重要的碳单质,结构模型分别如下图所示(其中石墨仅表示出其中的一层结构)。
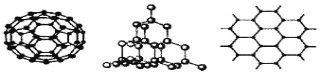
①金刚石中碳原子的杂化方式为 ;
②石墨层状结构中,平均每个正六边形占有的C—C键数是 个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.改用98%的浓硫酸
C.改用锌粒 D.滴加少量CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取CO2气体的过程中,不慎用到了浓盐酸,导致制得的CO2气体中混有HCl气体,他们设计了如下除去HCl气体并探究CO2与过氧化钠(Na2O2)反应的实验。
请回答下列问题:

(1)装置A的作用是: ;
(2)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含 ,该小组同学继续进行探究。
【提出问题】反应后硬质玻璃管中固体的成分是什么?
【做出猜想】猜想一:Na2CO3 猜想二:NaOH 猜想三:Na2CO3和NaOH,经过讨论,大家一致认为猜想二不合理,理由是: (用化学反应方程式表示)。
【实验验证】小组同学取上述形成的溶液M于试管中,向其中加入过量的 溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立。
【交流反思】小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论,你认为该同学的观点 (填“正确”或“错误”),理由是: (用化学反应方程式表示)。
【拓展延伸】在盛有氯化铵(NH4Cl)浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生,产生的气体是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修2 -化学与技未】
I.某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2 、A12O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:
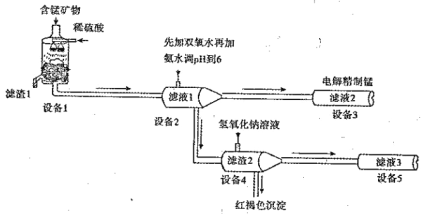
(1)设备Ⅰ中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。 滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:

①电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__ ___。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。

II.冰铜矿的主要成分是Cu2S、FeS,含有少许Al2O3和SiO2杂质。由冰铜矿冶炼金属铜的流程如下:
已知各离子沉淀的范围如下表
离子 | Fe3+ | Fe2 + | Cu2+ |
开始沉淀pH | 1.9 | 7.0 | 6.7 |
沉淀完全pH | 3.4 | 9.0 | 10.0 |
请回答下列问题:
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是 。
(2)溶液1的成分是 ,若向其中通入足量的CO2可以析出的沉淀是 ,此时溶液中的溶质将变成 。
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为: 。
(4)溶液2调节的pH范围为 。
(5)对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3。检验红褐色沉淀是否洗净的方法是 。
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为: ;当两极共产生标准状况下44.8 L气体且阴阳两极产生的气体体积之比为1: 1时,则析出的铜的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com