

分析 (1)甲是原电池,通入甲烷的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(2)乙池是电解池,将电能转化为化学能;
(3)丙池是电解池,C电极生成氯气、D电极生成氢气,且生成氯气和氢气物质的量之比为1:1,根据氯气和NaOH的关系式计算n(NaOH),再根据物质的量浓度公式计算氢氧化钠浓度;
(4)根据析出什么加入什么原则加入物质使溶液恢复原状.
解答 解:(1)甲是原电池,通入甲烷的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e-?CO3 2-+7H2O,故答案为:CH4+10OH--8e-?CO3 2-+7H2O;
(2)乙池是电解池,将电能转化为化学能,故答案为:电能;化学能;
(3)丙池是电解池,C电极生成氯气、D电极生成氢气,且生成氯气和氢气物质的量之比为1:1,生成氯气物质的量=$\frac{0.112L}{22.4L/mol}$=0.0025mol,根据氯气和NaOH关系式得n(NaOH)=2n(Cl2)=2×0.0025mol=0.005mol,则电解后c(NaOH)═$\frac{0.005mol}{0.5L}$=0.01mol/L,故答案为:0.01mol/L;
(4)阳极上生成氯气、阴极上生成氢气,相当于析出氯化氢,根据析出什么加入什么原则知,通入HCl气体能使溶液恢复原状,故答案为:HCl.
点评 本题考查电化学的相关知识,为高频考点,侧重考查学生分析计算能力,学生必须掌握原电池原理,明确基本理论内涵是解本题关键,易错点是电极反应式的书写,题目难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
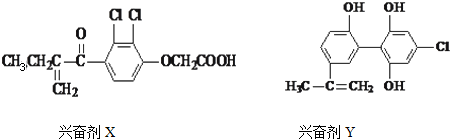
| A. | Y遇到氯化铁溶液时显紫色,Y能使溴的四氯化碳溶液褪色 | |
| B. | X的分子式为:C13H12O4Cl2 | |
| C. | 1molX与足量氢气反应,最多可消耗5molH2 | |
| D. | 1个Y分子中最多有8个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 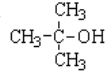 | B. | 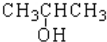 | C. | 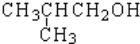 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、过滤、蒸发 | B. | 溶解、过滤、洗涤、干燥 | ||
| C. | 溶解、过滤、结晶 | D. | 溶解、结晶、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应,HCl表现还原性 | |
| B. | 反应②是复分解反应,HCl表现氧化性 | |
| C. | 反应③中HCl既有氧化性也有还原性 | |
| D. | 反应①中氧化剂和氧化产物的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除⑤外 | B. | 仅④⑤ | C. | 仅①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com