
����Ŀ����úת��Ϊˮú������Ҫ��ѧ��ӦΪC��s��+H2O��g��![]() CO��g��+H2��g����
CO��g��+H2��g����
C��s����CO��g����H2��g����ȫȼ�յ��Ȼ�ѧ����ʽΪ��
C��s��+O2��g���TCO2��g������H=��393.5kJmol��1
H2��g��+![]() O2��g���TH2O��g������H=��242.0kJmol��1
O2��g���TH2O��g������H=��242.0kJmol��1
CO��g��+![]() O2��g���TCO2��g������H=��283.0kJmol��1
O2��g���TCO2��g������H=��283.0kJmol��1
��ش𣺣�1��������������д��C��s����ˮ������Ӧ���Ȼ�ѧ��Ӧ����ʽ�� ��
��2���ȽϷ�Ӧ�����ݿ�֪��1mol CO��g����1mol H2��g����ȫȼ�շų�������֮�ͱ�1mol C��s����ȫȼ�շų��������࣮��ͬѧ�ݴ���Ϊ��úת��Ϊˮú������ʹúȼ�շų����������������ͬѧ���ݸ�˹������������ѭ��ͼ�����ݴ���Ϊ��úת��Ϊˮú����ȼ�շų���������úֱ��ȼ�շų���������ȡ�����������ס�����ͬѧ�۵���ȷ���� ����ס����ҡ������жϵ������� ��

���𰸡���1��C��s��+H2O��g��=CO��g��+H2��g����H=+131.5kJ/mol��
��2���ң���ͬѧ������úת��Ϊˮú��Ҫ����������
��������
�����������1�����ݸ�˹���ɣ���C��s��+O2��g��=CO2��g����H=��393.5 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
���ݸ�˹���ɣ��٩��ک��۵ã�
��2�����ݸ�˹���ɣ���ѧ��Ӧ������һ����ɻ��Ƿּ�����ɣ��䷴Ӧ������ͬ�ģ�Ҳ����˵����ѧ��Ӧ�ķ�Ӧ��ֻ�뷴Ӧ��ʼ̬����̬�йأ��뷴Ӧ;���أ������һ����Ӧ���Էּ������У��������Ӧ�ķ�Ӧ��֮����÷�Ӧһ�����ʱ�ķ�Ӧ����ͬ������úת��Ϊˮú��Ҫ����������
�⣺��1����C��s��+O2��g��=CO2��g����H=��393.5 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
���ݸ�˹���ɣ��٩��ک��۵ã�C��s��+H2O��g��=CO��g��+H2��g����H=+131.5kJ/mol��
�ʴ�Ϊ��C��s��+H2O��g��=CO��g��+H2��g����H=+131.5kJ/mol��
��2����ѧ��Ӧ������һ����ɻ��Ƿּ�����ɣ��䷴Ӧ������ͬ�ģ�Ҳ����˵����ѧ��Ӧ�ķ�Ӧ��ֻ�뷴Ӧ��ʼ̬����̬�йأ��뷴Ӧ;���أ������һ����Ӧ���Էּ������У��������Ӧ�ķ�Ӧ��֮����÷�Ӧһ�����ʱ�ķ�Ӧ����ͬ��úת��Ϊˮú��Ҫ����������
�ʴ�Ϊ���ң���ͬѧ������úת��Ϊˮú��Ҫ����������


 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵������ȷ����
A��1.68gFe������ˮ������Ӧ��ת�Ƶĵ�����ĿΪ0.09NA
B����31H��168O��ɵij���ˮ11g������������������Ϊ6NA
C��1L1mol��L-1��NaClO��Һ�к���ClO-����ĿΪNA
D��1mol����(P4)�������������ۼ���Ϊ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ɳ�����չ������أ�����������ȷ���ǣ� ��
A��ˮ�ࡢ��������ɡ�ˮ������觶����ڹ����ι�ҵ��Ʒ
B��������������þ���ǵ���ʣ���ҵ�Ͽ����ڵ����ȡ����þ
C���ô����Ʋ�����������ʯ�������ð���̼��臨��������������
D�����������ȼú��������β����������������߿�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ȡ���������Cl2����������������Ӧ��װ�ã�A��Cl2����װ�ã�C��DΪ���徻��װ�ã�EӲ�ʲ�������װ��ϸ��˿����FΪ����Ŀչ��ƿ���ձ�GΪβ������װ�ã��Իش�
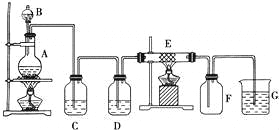
��1��C��G����װ����ʢ�ŵ��Լ��ֱ��ǣ� C G ��
��2����װ�ô������������Լ�飬д������������ ��
�������ƾ���Ӧ�ȵ�ȼ ������дA��B����Ŀ���� ��
��F�е�����Ϊ ��G�г�����һ�ֳ������ó����Ļ�ѧʽ ��
��3��д����A��E�з�����Ӧ�Ļ�ѧ����ʽΪ��
A�� ��
E�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����������������������أ�����˵����ȷ����
A. ����SO2���ŷţ����ԴӸ�������������
B. �����ס���ˮ����ǿ����������װʳƷ�ĸ���
C. ��ɫ��ѧ�ĺ��������û�ѧԭ���Ի�����Ⱦ��������
D. ҽ�������ƾ����Ҵ���Ũ��Ϊ95%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5��0��6��0֮�䣬ͨ���������Fe��OH��3������Fe��OH��3�������ԣ�������������������������о���ˮ�����á��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������á�ij����С���õ縡ѡ���۷�������ˮ�����װ����ͼ��ʾ��

��1��ʵ��ʱ����ˮ������Ũ�Ƚ�С�����������ϲ�����������ʻ�������ʹ�������γɸ������� ʱ��Ӧ����ˮ�м��������� ��
a��H2SO4 b��BaSO4 c��Na2SO4 d��NaOH
��2�����������ĵ缫��Ӧ�ֱ��Ǣ� ����4OH����4e��=2H2O��O2����
��3���缫��Ӧ�ٺ͢ڵ������ﷴӦ�õ�Fe(OH)3���������ӷ���ʽ�� ��
��4��������ȼ�ϵ����������̼����Ϊ����ʣ���CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫��
����֪�����ĵ缫��Ӧ��CH4+4CO32-- 8e��=5CO2+2H2O�������ĵ缫��Ӧ�� ��
��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ���Ϊ�˵�ع���ʱ�����в���A���ʲμ�ѭ������A���ʵĻ�ѧʽ�� ��
��5��ʵ������У���������������44��8 L����״�������壬��������ȼ�ϵ������CH4����״���� L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���̶��ݻ����ܱ������У�CO2��g����һ������C��s�������������»�ѧ��Ӧ��CO2��g��+C��s��2CO��g����
�ٸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
�ڸ÷�Ӧ�ķ�Ӧ������ʱ��ı仯ͼ����ͼ��ʾ��������˵����ȷ���� ������ţ���
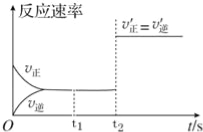
a��t1ʱ�̸÷�Ӧ�Ѿ����ڻ�ѧƽ��״̬
b��t2ʱ��c��CO2��=c��CO��
c��t2ʱ�̸÷�Ӧ��Ȼ���ڻ�ѧƽ��״̬
d��t2ʱ�̣��ı������������������C�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ12.64g KMnO4�������һ��ʱ����ռ���amolO2����Ӧ������Ĺ����м���������Ũ���ᣬ���ռ���bmolCl2����ʱMnԪ��ȫ����Mn2+����ʽ��������Һ�С�
��1������ɲ���ƽ���л�ѧ����ʽ��
K2MnO4+ HCl �� KCl+ MnCl2+ Cl2��+![]()
��2�������Ը��������Һ�ζ�FeSO4��Һд���÷�Ӧ�����ӷ���ʽ______________��
��3����KMnO4�����������O2 a molֵ���ʱ����Ӧ������Ĺ����м���������Ũ���Ტ���ȣ�����Cl2�����ʵ���b= mol��(��ʱMnԪ��ȫ����Mn2+����ʽ��������Һ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤��������ֵ������������ȷ������ ��
A��16g CH4����ԭ����ĿΪNA
B��1mol��L��1 NaCl��Һ����NA��Na+
C�����³�ѹ�£�22.4L CO2�к���NA��CO2����
D��2.4g Mg���������ᷴӦת�Ƶĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com