
【题目】已知强酸与强碱在稀溶液里发生中和反应生成1molH2O时放出57.3kJ热量。用500mL 0.6mol/L 的稀硫酸跟足量的NaOH溶液反应,放出的热量是( )
A. 68.76kJB. 57.3kJC. 34.38kJD. 17.19kJ
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________;
(2)X与金属钠反应放出氢气,反应的化学方程式是____________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化作用下反应生成Y,Y的结构简式是________;
(4)X与高锰酸钾酸性溶液反应可生成Z,Z的名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的真空密闭容器中加人1 mol CaCO3,发生反应:CaCO3(s) ![]() CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.
CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.

请回答下列问题:
(1)已知:①CaO(s)+SO2(g)==CaSO3(s) △H1=-402kJ·mol-1
②2CaCO3(s)+2SO2(g)+O2(g)==2CaSO4(s)+2CO2(g) △H2=-2762kJ·mol-1
③2CaSO3(s)+O2(g)==2CaSO4(s) △H3=-2315kJ·mol-1
则:CaCO3(s)==CaO(s)+CO2(g)的△H=____kJ·mol-1
(2)①温度为T5℃时,反应CaCO3(s) ![]() CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
②如果该反应的平衡常数K值变大,该反应____(选填编号)。
A.一定向逆反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向正反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则达到平衡时CaCO3的质量____(填“增大”、“减小”或“不变”)。
(4)在T5℃下,反应达到平衡状态后,再压缩容器为1L,重新达到平衡时,CO2的浓度____(填“增大”、“减小”或“不变”)
(5)随着温度的升高,曲线B向曲线A逼近的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有①0.112L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
A. 分子数:①③②④B. 密度:④①③②
C. 质量①④③D. 氢原子数:②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
(1)△H ____________ 0(填“<”或 “>”)。
(2)830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)判断该反应是否达到平衡的依据为
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计如下实验方案,以分离KCl和BaCl2的固体混合物,试回答下列问题:
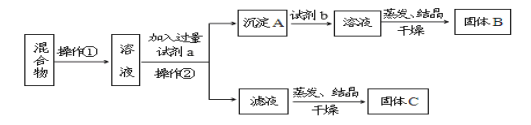
供选择的试剂有:盐酸、硫酸钾溶液、碳酸钾溶液、碳酸钠溶液
(1)操作①的名称是_____,操作②的名称是_____。
(2)试剂a是_____,试剂b是_____,固体B化学式_____。
(3)加入试剂a所发生的化学反应方程式为:____。加入试剂b所发生的化学反应方程式为:___。
(4)乙同学认为该方案不能达到实验目的,理由是:_____ ;应如何改进____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D 可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E 元素原子的K、L层电子数之和等于其M 、N 层电子数之和。请回答下列各题(涉及元素请请用相应化学符号表示):
(1)B、C、D 三种元素中电负性由大到小的排序为__________(用元素符号回答),其中D 元素基态原子的电子排布图为________________。
(2)在B的基态原子中,核外存在___________对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示。晶体中E2+周围等距且最近的E2+有__________个; E 和B 可形成的晶体的晶胞结构与NaCl晶体的相似(如图2 所示),但该晶体中含有B22-的存在,晶体中E2+的配位数为__________,该化合物的电子式为______________。

(4)用高能射线照射液态H时,一个H 分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若千H 分子形成的“网”捕获。你认为H分子间能形成“网”的原因是________________。
②由H 分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2 的水溶液反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 分子固体中只存在分子间作用力,不含有其它化学键
B. 形成共价键的元素一定是非金属元素
C. 共价键的饱和性与原子轨道的重叠程度有关
D. σ 键可以单独形成且可以绕键轴旋转,π 键不行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.

请根据混合物分离或提纯的原理,将A、B、C、D 填入适当的空格中.
(1)用四氯化碳碘水中提取碘_____;
(2)除去粗盐中的泥沙_____;
(3)与海水晒盐原理相似的是_____;
(4)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com